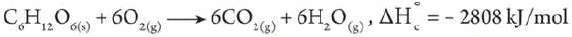الأحتراق
- هى عملية اتحاد سريع للمادة مع الأكسجين
- ينتج عن الأجتراق التام للعناصر أو المركبات انطلاق طاقة في صورة حرارة أو ضوء أو كلاهما ، وتعرف كمية الحرارة المنطلقة بحرارة الأحتراق ΔHc
- تفاعل الاحتراق طارد للحرارة وبالتالي فأن ΔHc دائماً بإشارة سالبة.
حرارة الاحتراق ΔHc
- كمية الحرارة المنطلقة عند احتراق المادة احتراقاً تاماُ في وفرة من الأكسجين.
- إذا تم الاحتراق في الظروف القياسية فإن كمية الحرارة المنطلقة تعرف بحرارة الاحتراق القياسية ΔHco
حرارة الاحتراق القياسية ΔHco
- هي كمية الحرارة المنطلقة عند احتراق مول واحد من المادة احتراقاً تاماً في وفرة من الأكسجين في الظروف القياسية.
- ينتج عن احتراق معظم المواد العضوية (كالوقود والجلوكوز):
(1) ماء H2O
(2) ثاني أكسيد الكربون CO2
(3) طاقة حرارية
مامعنى قولنا أن حرارة الاحتراق القياسية للجلوكوز 2808kJ/mol- ؟
أى أن كمية الحرارة المنطلقة عند احتراق 1mol من الجلوكوز احتراقاُ تاماً في وفرة من الأكسجين في الظروف القياسية تساوي 2808kJ
أمثلة على تفاعلات الأحتراق
(1) تفاعل احتراق غاز البوتاجاز
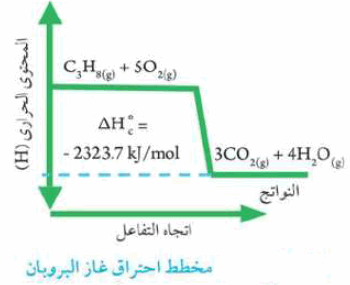
- غاز البوتاجاز عبارة عن خليط من غازي البروبان والبيوتان
- ينتج عن احتراق غاز البروبان في وفرة من غاز الأكسجين كمية كبيرة من الحرارة تكفي لطهي الطعام وغيرها من الاستخدامات.
- المعادلة التالية والمخطط التالي يوضحان تفاعل احتراق غاز البروبان:
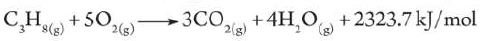
(2) تفاعل احتراق الجلوكوز داخل جسم الكائن الحي
- يعتبر احتراق الجلوكوز داخل جسم الكائن الحي من تفاعلات الاحتراق الهامة وذلك لأن الحرارة الناتجة عنه تمد الكائن الحي بالطاقة اللازمة للقيام بالعمليات الحيوية المختلفة.