أولاً/ الفرق بين الكحول والفينول نظرياُ
(1) التركيب الكيميائي Chemical Structure
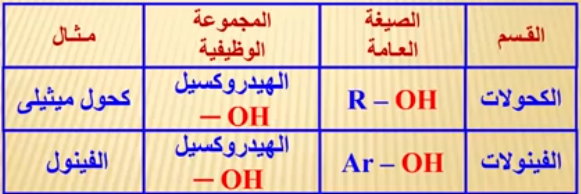
- المجموعة الوظيفية فى كلاً من الكحول والفينول هى مجموعة الهيدروكسيل (OH).
- ولكن في الكحول تتصل مجموعة الهيدروكسيل مباشرة بمجموعة ألكيل أما فى الفينول فتتصل بمجموعة أريل.
(2) الأشتقاق
- الكحولات هيدروكربونات أليفاتية أما الفينولات هيدروكربونات آروماتية.
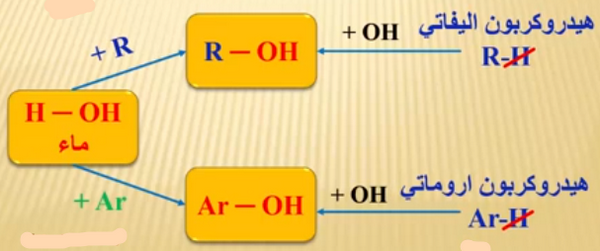
- يمكن اشتقاق الكحولات والفينولات من الماء باستبدال ذرة الهيدروجين فى الماء مرة إلى ألكيل فتعطى كحول ومرة إلى آريل فتعطي فينول.
- يمكن اشتقاق الكحول من الهيدروكربونات الأليفاتية (R-H) باستبدال ذرة الهيدروجين فى الهيدروكربون إلى مجموعة هيدروكسيل فتعطى كحول
- واشتقاق الفينول من الهيدروكربونات الأروماتية (Ar-H) باستبدال ذرة الهيدروجين فى الهيدروكربون إلى مجموعة هيدروكسيل فتعطى فينول.
(3) الحالة الفيزيائية Physical State
- المركبات الأولى من الكحولات (مثل الكحول الميثيلي والكحول الإيثيلي) سوائل.
- الفينول مادة صلبة بللورية لها رائحة المستشفيات (لأنها مركب آروماتى عطري).
(4) الذوبانية Solubility
- بسبب مقدرة الكحولات على تكوين روابط هيدروجينية مع جزئيات الماء فأن الكحولات ذات الوزن الجزيئي المنخفض تذوب بأى كمية فى الماء (∞) مثل الميثانول والإيثانول والبروبانول وكحول الأليل.
- للفينولات ذائبية منخفضة فى الماء بسبب إحتواء هيكلها الكربوني على ست ذرات كربون على الأقل وتزداد ذوبانية الفينولات بزيادة مجموعات الهيدروكسيل على الحلقة حيث تبلغ ذائبية الفينول 9.3g/100ml H2O وذائبية الكاتيكول 45g/100ml H2O
(5) درجة الغليان Boiling Point
للفينولات درجات غليان مرتفعة بسبب مقدرتها على تكوين روابط هيدروجينية بين جزئياتها وبمقارنتها بالكحولات المقابلة لها فى الوزن الجزيئي.
- درجات غليان الفينولات أعلي الكحولات المقابلة لها فى الوزن الجزيئي وذلك بسبب حلقة الفينيل الساحبة للألكترونات التى تزيد من إستقطاب الرابطة O-H فى مجموعة الهيدوكسيل فتكون روابط هيدروجينية أقوى من التى تكونها الكحولات.
- مثال على ذلك: الفينول والسايكلوهكسانول لهما درجتى غليان 182، 161 درجة مئوية على الترتيب .
(6) الحامضية Acidity
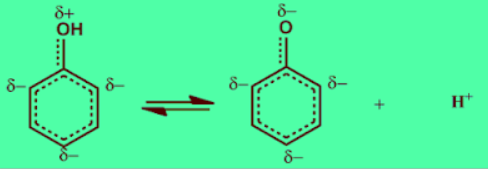
- الفينولات اكثر حموضة من الكحولات بسبب:
(أ) الرنين الموجب يزيد قيمة الشحنة الموجية علي ذرة الاكسجين التي تساعد علي سهولة تأين الفينول الي آيونات هيدروجين موجبة وآيون الفينوكسيد السالب.
(ب) المجموعة المعطية للالكترونات لها تأثير طفيف أو لا يذكر علي قوة الحموضة.
(جـ) المجموعات الساحبة تزيد الحموضة
ثانياُ/ الفرق بين الكحول والفينول معملياُ
(1) ورقة عباد الشمس لإختبار الحموضة litmus test
- ضع قطرة من محلول الفينول على ورقة عباد الشمس الزرقاء وكذلك قطرة من الكحول على ورقة عباد الشمس الزرقاء.
- الفينول يغير ورقة عباد الشمس الزرقاء إلى حمراء لذا فهى حامضية. (تقريباُ pH = 4)
- الكحولات لا تظهر أى تغير على ورق عباد الشمس فهى متعادلة. (تقريباُ pH = 7)
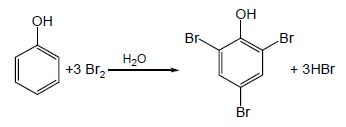
(2) ماء البروم Bromine water
- ماء البروم سائل بني المحمر ( بين الأصفر والاحمر) يكشف على عدم التشبع (الروابط الثنائية والثلاثية).
الكحول + ماء البروم ← لا يزول لون ماء البروم ويبقى المحلول بني محمر
الفينول + ماء البروم ← يزول لون ماء البروم ويتكون راسب أبيض

(3) التفاعل مع كلوريد الحديدك FeCl3
- من أهم الكواشف التى تميز الفينولات عموماُ هو كاشف كلوريد الحديدك
- تفاعل كلوريد الحديدك مع الفينول يعطى لون بنفسجي حيت تتكون معقدات مع الحديد.
- أما عند إضافة كلوريد الحديدك إلى الكحولات فلا تتفاعل وتعطي محاليل غير ملونة.
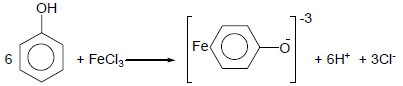

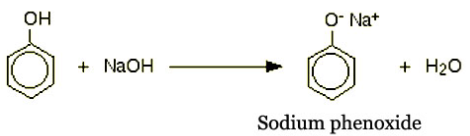
(4) التفاعل مع هيدروكسيد الصوديوم NaOH
- الكحولات لا تتفاعل مع هيدروكسيد الصوديوم فهى محاليل متعادلة وتشابه حامضيتها حامضية الماء.
- يتفاعل الفينول مع هيدروكسيد الصوديوم ويعطي فينوكسيد الصوديوم ( راسب أبيض يزول بالرج ويعود بإضافة المزيد من NaOH).

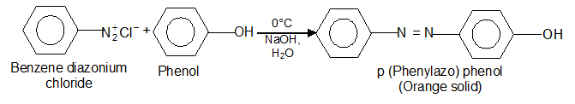
(5) التفاعل مع أملاح الديازونيوم diazonium salts
- لا يحدث أى تفاعل مع الكحولات.
- تتفاعل الفينولات مع أملاح الديازونيوم وتكون أصباغ الأزو الملونة Azo dyes ويسمى بتفاعل الإزدواج Azo coupling reaction

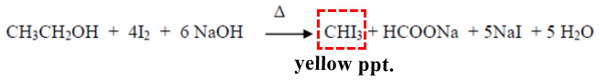
(6) اختبار أيودوفورم Iodoform test
- لا يحدث تفاعل فى حالة الفينول.
- فى أنبوبة أختبار ضع 5 مل من الكحول + قطرات من محلول اليود 1% + قطرات من NaOH 10% ثم ضع الناتج فى حمام مائي ساخن لمدة 5 دقائق ، تتكون راسب أصفر من الأيدوفورم CH3I