التهجين فى أيون الهيدرونيوم
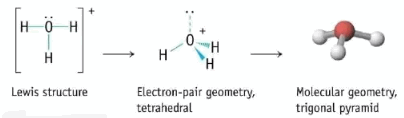
- أيون الهيدرونيوم يتكون من ثلاث ذرات هيدروجين وذرة واحدة أكسجين ويتكون من الماء بالطريقة التالية:

- يمكن معرفة نوع التهجين لأى مركب أو أيون عن طريق حساب Steric number
- Steric number = عدد الذرات المرتبطة بالذرة المركزية + عدد الأزواج الحرة التى تمتلكها الذرة المركزية
- فإذا كان:
Steric number = 2 → Linear → Sp hypridization
Steric number = 3 → Trigonal planar → Sp2 hypridization
Steric number = 4 → Tetrahedral → Sp3 hypridization
Steric number = 5 → Trigonal bipyramidal → dSp3 hypridization
Steric number = 6 → Octahedral → d2Sp3 hypridization
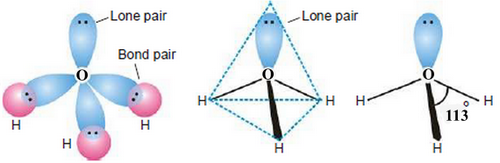
فى حالة أيون الهيرونيوم +H3O يكون عدد الذرات المرتبطة الأكسجين = 3 ذرات هيدروجين ، وعدد الازواج الحرة التى تحتوى عليها ذرة الأكسجين زوج واحد فقط ويكون:
Steric number = عدد الذرات المرتبطة بالذرة المركزية + عدد الأزواج الحرة التى تمتلكها الذرة المركزية
Steric number = 3 +1 = 4
وعلى ذلك يكون التهجين من النوع Sp3 والشكل الهندسي الألكتروني هو Tetrahedral وبما أن الأوربتال العلوى يحتوى على ألكترونين ولا يحتوى على ذرات فأن الشكل الهندسي للجزئ هو Trigonal pyramidal
Elertroic geometry : Tetraderal
Molecular geometry : Trigonal pyramidal
- الزواية بين الروابط bond angle تساوي 113o
- زوج الالكترونات الحر الموجود على ذرة الأكسجين يكون كثافة الكترونية عالية حوله فيزداد التنافر بينه وبين أزواح الروابط O-H ويجبرهم على الاقتراب من بعضهم لتكوين شكل رباعي السطوح.
- ونظراً للسالبية الكهربية العالية للأكسجين فأن زوج الألكترونات الحر يقضى معظم وقته بالقرب من الأكسجين فتكون الزاوية 113o بدلاً من 109.5o