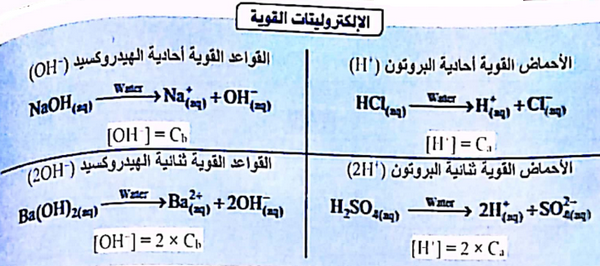
حساب تركيز آيونات الهيدروجين والهيدروكسيد فى الإلكتروليتات القوية
- نفرض أن Ca = تركيز الحمض ، Cb = تركيز القاعدة
أولاً/ فى حالة الأحماض القوية
(1) الأحماض القوية أحادية البروتون (+H)
(HCl(aq) → H+(aq) + Cl-(aq
Ca = [H+]
(2) الأحماض القوية ثنائية البروتون +2H
(H2SO4(aq) → 2H+(aq) + SO42-(aq
Ca × 2 = [H+]
ثانياً/ فى حالة القواعد القوية
(1) القواعدالقوية أحادية الهيدروكسيد (-OH)
(NaOH(aq) → Na+(aq) + OH-(aq
Cb = [OH-]
(2) القواعد القوية ثنائية الهيدروكسيد (-2OH)
Ba(OH)2(aq) → Ba2+(aq) + 2OH-(aq)
Cb × 2 = [OH-]
وهذا ملخص للقوانين السابقة:
أحسب تركيز أيونات الهيدروجين في محلول NaOH تركيزه 0.05M؟
الحل:
اولاً/ حساب pOH
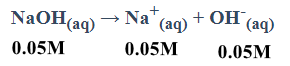
[-OH] = Cb = 0.05M
pOH = - log[OH-] = -log (0.05) = 1.3
ثانياً/ حساب pH
pH + pOH = 14
pH = 14 - pOH
pH = 14 - 1.3 = 12.7
ثالثاً/ حساب تركيز أيونات الهيدروجين
pH = - log[H+] = 12.7
[+H] = 1.995 *10-13