دورة بورن هابر Born - Haber Cycle
- يصاحب تكوين المركبات الأيونية ظهور طاقة ، وكلما زادت هذه الطاقة يزداد المركب الأيوني ثباتاً واستقراراً.
- ويمكن حساب طاقة تكوين المركب الأيوني وذلك بجمع التغيرات في الطاقة لجميع الخطوات اللازمة لتكون المركب الأيوني من عناصره باستخدام قانون هس.
مثال توضيحي: حساب طاقة تكوين مركب كلوريد الصوديوم من عناصره:
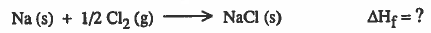
تكوين مركب كلوريد الصوديوم من عناصره يمر بالخطوات التالية:
(1) تكوين غاز الصوديوم وذلك بـتـحـوبل الصوديوم الصلب إلى غاز ، وتحتاج هذه العملية إلى طاقة تسمى (طاقة التسامي) :

(2) تكوين ايون الصوديوم ( تأين الصوديوم) ، وهذه العملية تحتاج إلى طاقة تسمى (طاقة التأين ionization energy):

(3) تکوین ذرات الـكلـور وذلك مـن خـلال كـسـر الـرابطة بين ذرتي الـكلـور فـي جـزئ الكلور ، وهذه العمليـة تـحـتـاج إلى طاقـة تسمى (طاقة الرابطة bond energy) وتسمى ايضاً بطاقة التذرية energy atomization
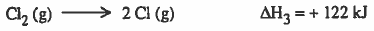
(4) تكوين أيون الكلور (تأين الكلور) ، وهذه العملية ينتج عنها طاقة تسمى (طاقة الألفة الإلكترونية electron affinity energy)

(5) تكوين كلوريد الصوديوم الصلب وذلك من اتحاد (+Na ) مع ( --Q ) ، وهذه العمليـة ينتج عنها طاقة تسمى (طاقة الشبكة البلورية lattice energy)

يمكن حساب قيمة طاقة التكوين Hf∆ بجمع التغيرات في الطاقة كما يلي:
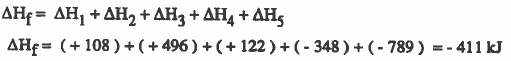
ملاحظات هامة
(1) لوجمعنا طاقات جميع الخطوات باستثناء الخطوة الخامسة نجد أنها ماصة للحرارة ( 378+) ولا تؤدي إلى الاسـتـقـرار . لكن عند إضـافـة الخطوة الخـامـسـة اي طـاقـة الشبكة البلورية (789-) نجد ان التفاعل الكلي أصبح طارداً للحرارة (411-) أي أن المركب الأيوني صاحبه استقرار . لذلك يمكن الاستنتاج أن طاقة الشبكة البلورية هي المسئولة الرئيسية عن تكون وثبات المركب الأيوني.
ملاحظة: طاقة التفاعل لو كانت بالموجب لما تكونت الرابطة الأيونية مطلقاً.
(2) نلاحظ أن الطاقة الناتجة (المنطلقة) تساوي (411kJ) وهذا يعني ان طاقة الوضع ( الداخلية ) انخفضت نتيجة للتفاعل بمقدار (411kJ) وهذا يعني أن طاقة النواتج أقل من طاقة المتفاعلات ، أي أن النواتج أكثر استقراراً من العناصر المتفاعلة.
طاقة نواتج + 411 كيلو جول = طاقة المتفاعلات
طاقة النواتج < طاقة المتفاعلات
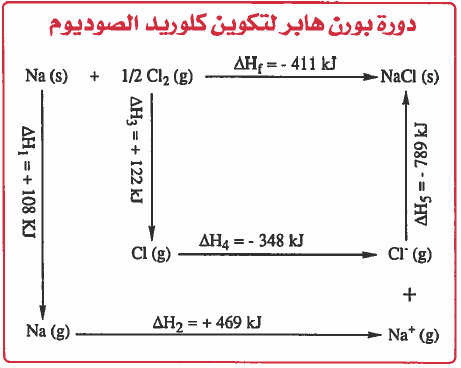
ويمكن اختصار العمليات السابقة فى المخطط التالي والذي يعرف بدائرة بورن هابر Born - Haber Cycle
أمثلة محلولة على دورة بورن - هابر
مثال (1): أحسب طاقة تكوين مركب اكسيد الماغنسيوم من عناصره
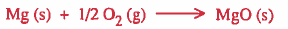
علماً بان تكوین مرکب المغنيسيوم من عناصره يمر بالخطوات التالية:
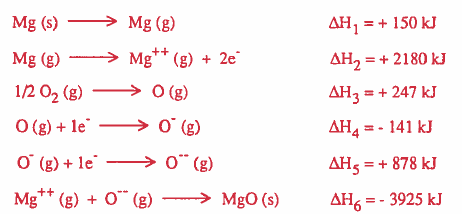
الحل:
يمكن حساب قيمة طاقة التكوين Hf∆ بجمع التغيرات في الطاقة كما يلي:
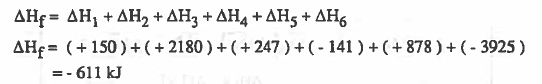
وهذا يعني أن طاقة الوضع ( الداخلية) انخفضت نتيـجـة للتفاعل بحـقـدار (611KJ) وهذا يعني أن طاقة النواتج أقل من طاقة المتفاعلات ، اي أن النواتج أكـثـر اسـتـقـراراً من العناصر المتفاعلة.
411KJ + طاقة النواتج = طاقة المتفاعلات
ويمكن اختصار العمليات السابقة في المخطط التالي والذي يعرف بدائرة بورن هابر - Born Haber Cycle
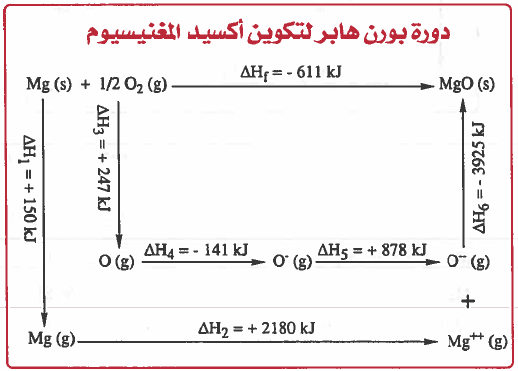
ملاحظة: مركب NaCl2 غير ثابت أى أنه لا يمكن ان يتكون بتفاعل الصوديوم مع الكلور ويمكن إثبات ذلك من خلال المثال التالي.