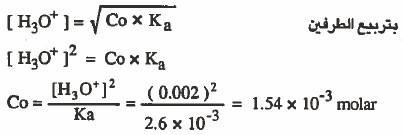Weak Acids الأحماض الضعيفة
- الحمض الضعيف: هو مادة تتفكك جزئيا في الماء لتنتج أيونات الهيدرونيوم.
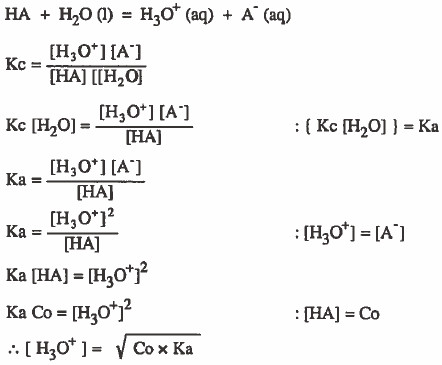
- وبذلك ففي حالة الأحماض الضعيفة نستخدم القانون التالي:
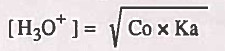
حيث أن:
Co = التركيز الأصلي للحمض الضعيف .
Ka = ثابت تفكك الحمض الضعيف.
ملاحظة هامة:
كلما زادت قيمة Ka زادت قيمة [+H3O] ومن ثم زادت قوة الحموضة
ثابت تفكك الحمض الضعيف:
هو ثابت اتزان تفاعل انتقال البروتون من الحمض الضعيف إلى الماء.
ما الفرق بين تركيز الحمض وقوته
- تتحدد قوة الحمض بمقدار ما يعطيه من أيونات الهيدرونيوم عند تفككه في الماء ويمكن الاستدلال عليه من قيمة Ka.
- أما تركيز الحمض فيتحدد تركيزه بعدد مولات أو وزن الحمض المذاب في لتر من المحلول.
أمثلة على الأحماض الضعيفة
- حمض الخل CH3COOH
(Ka = 1.8 x 10-5)
-CH3COOH + H2O = H3O+ + CH3COO
- حمض الهيدروسيانيك HCN
(Ka= 4.9 x 10-10)
-HCN + H2O = H3O+ + CN
- حمض النيتروز HNO2
(Ka = 4.5 x 10-4)
+HNO2 + H2O = NO2- + H3O
- حمض الفورميك HCOOH
(Ka = 1.8 x 10-4)
-HCOOH + H2O = H3O+ + HCOO
- حمض الفلور HF
( Ka = 1.8 × 10-4 )
-HF + H2O = H3O+ + F
قاعدة هامة
كلما زادت قيمة Ka زادت قيمة [+H3O] وزادت قوة الحموض
مسائل محلولة على pH للأحماض الضعيفة
مثال (1): احسب قيمة OH-] ، [H3O+] ، pOH ، pH] لمحلول تركيزه 0.005M من حمض الخل (CH3COOH) ، علماً بأن ثابت تفكك حمض الخل يساوي 5-10 × 1.8
الحل:
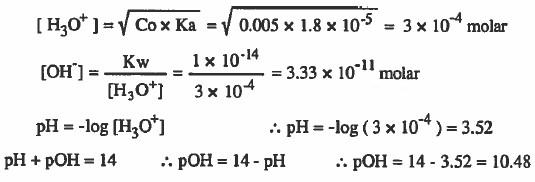
مثال (2): أذيب (0.003mol) من حمض الهيدروسيانيك (HCN) في كمية من الماء بحيث أصبح حجم المحلول ( 150mL) ، احسب قيمة pH علماً بأن Ka (HCN) = 4.9 x 10-10
الحل:
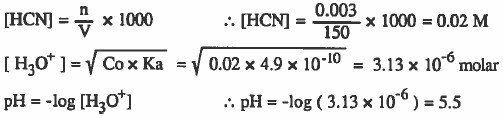
مثال (3): أذيب (3g) من حمض الخل (CH3COOH) في كمية من الماء بحيث Ka = 1.8 × 10-5 أصبح حجم المحلول نصف لتر، أحسب قيمة pH علماً بان الأوزان الذرية : 16 = H = 1 & C = 12 & O
الحل:
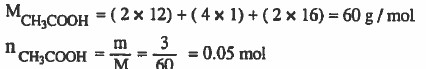
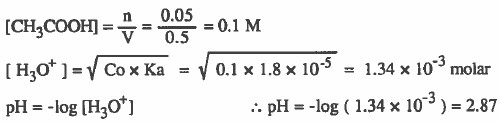
مثال (4): حضر طالب محلول حمض النيتروز (HNO2) الذي تركيزه 0.1M ، وقاس تجريبياً pH للمحلول ووجدها تساوي (2.2) . احسب ثابت التفكك لحمض النيتروز (Ka)
الحل:
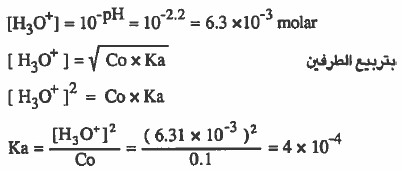
مثال (5): رتب الحموض التالية ترتيبا تصاعديا حسب ازدياد قوتها :
HNO2 → Ka = 5.1 x 10-4
H2SO3 → Ka = 1.7 x 10-2
H3PO4 → Ka = 1.7 × 10-3
الحل:
كلما زادت قـيمـة Ka زادت قيـمـة [+H3O] ومن ثم زادت قوة الحموضـة لذلك ترتب المواد تصاعدياً (من الأقل إلى الأعلى) كما يلي:
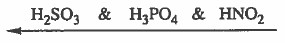
مثال (6): محلول لحمض ضعيف ثابت تفككه 3-10 × 2.6 أحـسـب تـركـيـز الحمض إذا كان تركيز أيونات الهيدرونيوم تساوي 3-10 × 2
الحل: