تفاعلات الاستبدال الالكتروفيلي للفينولات
- مجموعة OH- في الفينولات منشطة للحلقة الأروماتية مثلها مثل المجموعة الأمينية، لذا تخضع الفينولات لتفاعلات الاستبدال الالكتروفيلية وتتوجه المجموعات البديلة الجديدة إلى موضعي أرثو وبارا فهي المواضع الغنية بالالكترونات مقارنة بالموضع ميتا.
(1) النترتة Nitration
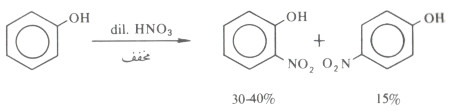
- تحدث نترتة الفينول بسهولة بواسطة حمض النتريك المخفف وعند درجة حرارة الغرفة، وينتج عن هذا التفاعل تكون مزيج من أرثو وبارا نيتروفينول.
- ويمكن فصل المتشابهين عن بعضهما بواسطة التقطير البخاري إذ أن المتشابه أرثو أكثر تطايراً.
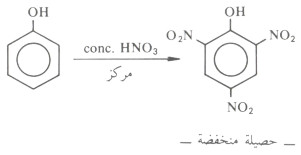
- أما استخدام حمض النتريك المركز كعامل نترتة فيؤدى إلى نشوء ثلاثي نيترو فينول (حمض بيكريك) - وبمردود ضعيف - بالإضافة إلى مواد ثانوية غير معروفة البنية التركيبية نظراً لسهولة أكسدة الحلقة الأروماتية بواسطة حمض النتريك.
(2) النترزه Nitrosation
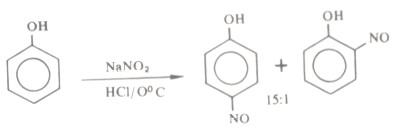
- تتفاعل الفينولات مع حمض النيتروز وتنشأ حصيلة جيدة من بارا نيتروزوفينول وآثار بسيطة من أرثو نیتروزو فينول>
- وتحدث النترزه بسهولة على الرغم من أن أيون النيتروزونيوم nitrosonium عامل الكتروفيلي ضعيف الأمر الذي يشير إلى الفعالية الشديدة للحلقة في مركب الفينول أو مشتقاته.
(3) السلفنة Sulphonation
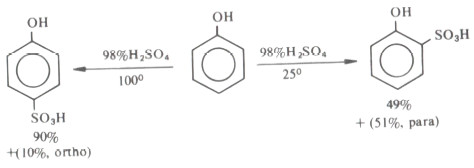
- يتفاعل الفينول مع حمض الكبريتيك المركز (۹۸٪) ويتكون خليط بنسب متساوية من مشتق أرثو ومشتق بارا إذا ما كانت درجة حرارة التفاعل ٢٥مo
- في حين أن حصيلة المشتق بارا هي الحصيلة الرئيسية إذا ما أجرى التفاعل عند درجة حرارة ١٠٠م.
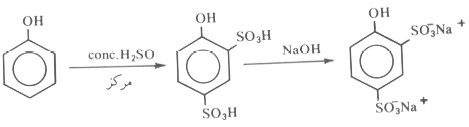
كذلك فإن استخدام حمض الكبريتيك المركز قد يعطي حصيلة جيدة من حموض ثنائي السلفون والتي يمكن عزلها على هيئة الملح الصوديومي ويمكن استخدامها في تحضيرات مخبرية.
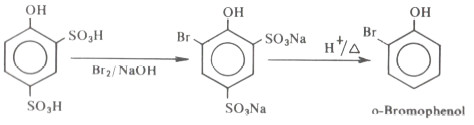
(4) الهلجنة
- تؤدى معاملة الفينول بالكلور أو ماء البروم إلى تكون راسب في الحال من مشتق عديد الهالوجين.
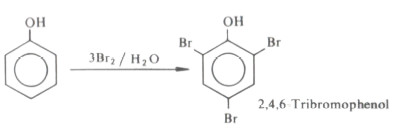
- هذا ويمكن ضبط الظروف الملائمة لإدخال ذرة هالوجين أو أكثر في مواضع الأرثو والبارا المتوفرة في الفينولات المختلفة.
- فإذا ما أريد الحصول على مركب أحادي البروم للفينول فيستخدم ثاني كبريتيد الكربون كمذيب بدلاً من الماء.
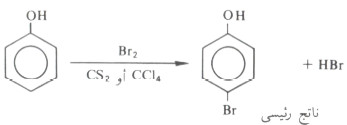
- ويعزى الاختلاف في نواتج هذا التفاعل عند تغير المذيب إلى أن العامل النيكلوفيلي في حالة استخدام الماء كمذيب هو أيون الفينوكسيد الناتج من تأين الفينول في الماء والذي يهاجم من قبل الكاشف الالكتروفيلي (البروم) حيث أن أيون الفينوكسيد أنشط من الفينول تجاه الكواشف الالكتروفيلية في الإستبدال الأروماتي الالكتروفيلي.
- أما المماكب أرثو فيمكن تحضيره وذلك بحماية أحد موضعي الأرثو بالسلفنة المباشرة ثم البرومة، وأخيراً يتم نزع مجموعة السلفون من لحلقة الأروماتية.
(5) تفاعل كولب Kolbe reaction
- إن تفاعل أنيون الكربون مع ثاني أكسيد الكربون ليعطي الأحماض الكربوكسيلية له أهميته في تفاعلات الفينولات.
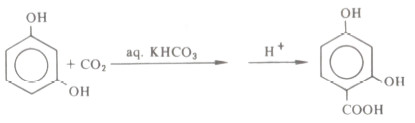
- ويعرف تفاعل الملح الصوديومي للفينول نفسه مع ثاني أكسيد الكربون عند درجة حرارة ١٣٠ - ١٤٠مo بتفاعل كولب، وينشأ تحت هذه الظروف حمض ساليسيليك Salcylic.
- وتجدر الإشارة إلى أن هذه الطريقة هي الطريقة الصناعية لتحضير حمض ساليسيليك.
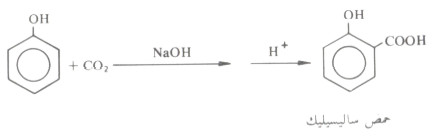
هذا وقد يحدث الاستبدال في الوضع بارا إذا ما ارتفعت درجة حرارة هذا التفاعل إلى ٢٥٠مo.
(6) تفاعل ريمر - تيمان Reimer Teiman
- تفاعل ريمر - تيمان هو تفاعل الفينول مع الكلور فورم في الوسط القاعدي، وينتج مركب ٢ - هيدروكسي بنزالدهيد (ناتج رئيسي) إذا ماسخن خليط التفاعل عند درجة حرارة 60 مo
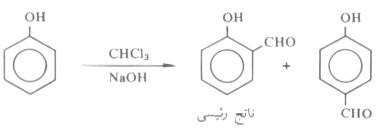
وإذا كان أحد موضعي أرثو مشغولاً فإن الاستبدال يحدث في الموضع بارا كما يتضح من المثال التالي:
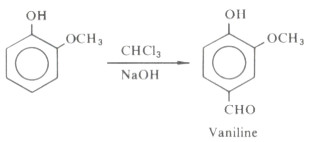
- أما فيما يتعلق بالنسبة المئوية للمردود فإنها تختلف باختلاف مشتق الفينول الداخل في التفاعل، وقد وجد أنها تتراوح من ٥ إلى ٣٥% بشكل عام.
- وتشتمل ميكانية هذا التفاعل على نشوء ثنائي كلورو كربين من تفاعل الكلوروفورم مع القلوى.
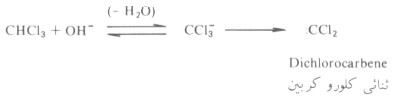
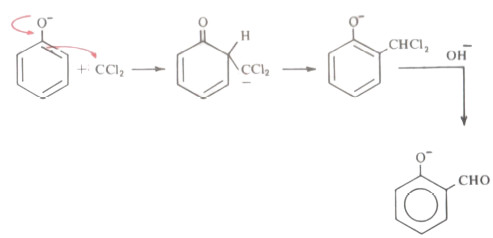
- يهاجم بعد ذلك ثنائي كلورو كربين أيون الفينوكسيد ليعطي مركب وسطي لا يلبث أن يتحلل مائياً كما يتبين من التالي:
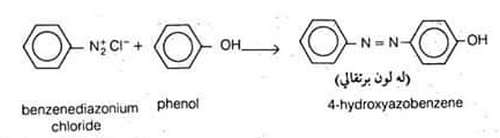
(7) ازدواج (اقتران) الفينولات
- تزدوج الفينولات في الوسط القاعدي مع أملاح الديازونيوم لتكون مركبات آزو ذات أهمية صناعية في الأصباغ.
- وهذا التفاعل هو تفاعل استبدال الكتروفيلي على الحلقة بواسطة كاشف الكتروفيلي ضعيف هو أيون الديازونيوم.
- تتفاعل أملاح الديازونيوم مع الفينولات والأمينات الأروماتية في وسط قلوي طريق الإستبدال الأروماتي الالكتروفيلي لتعطي مركبات تسمى مركبات الأزو، وفيها تحتفظ هذه الأملاح بالنيتروجين.
- ويسمى هذا التفاعل بتفاعل الإزدواج وتحصل تفاعلات الازدواج في حالة وجود مجاميع مانحة للالكترونات على الحلقة بمعنى آخر وجود مجاميع ساحبة للألكترونات ( مجاميع مثبطة) تمنع حدوث التفاعل.