- قوة أي حمض HA في محلول مائي هو مقياس لقدرته على منح بروتون (H+) لجزئي الماء.
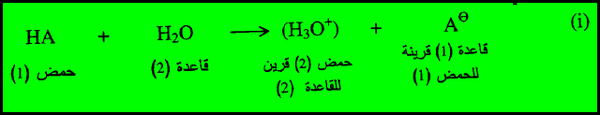
- الحمض الضعيف هو حمض يتفكك جزئياً ولا يحرر جميع أيونات الهيدروجين التي يحويها في المحلول، أي أنه لا يهب جميع البروتونات أما الحمض القوي هو حمض يحرر جميع أيونات الهيدروجين عند إذابتها في الماء.
- حمض الفوسفوريك حمض ثلاثي الوظيفة، بحيث أن كل هيدروجين تحدث لها عملية إماهة فتتشكل أيونات الهيدرونيوم الموجبة (كاتيونات) على ثلاث مراحل (وليس على مرة واحده) بالإضافة إلى أنيونات الفوسفات الموافقة (الأيونات السالبة) وهي الفوسفات ثنائية الهيدروجين، والفوسفات أحادية الهيدروجين، والفوسفات
- يعتبر حمض الفسفوريك حمض ضعيف لأنه يفقد ذرات الهيدروجين على مراحل
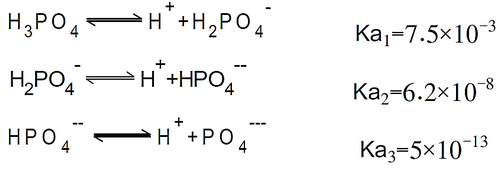
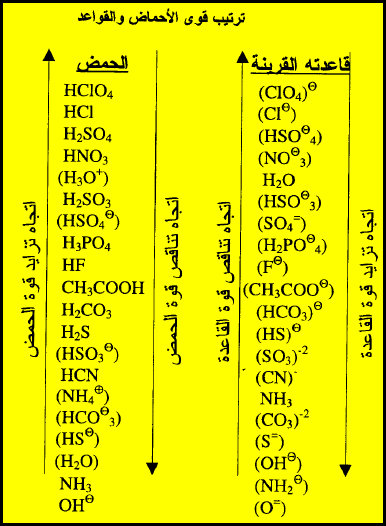
- هذا الجدول يوضح ترتيب قوة الأحماض:
قوة الأحماض الأكسجينية
عموماً فأن قوة الأحماض الأكسجينية التي لها الصيغة العامة HO)m ZOn)
مثل حمض الفسفوريك HO)3 PO1 = H3PO4) يمكن مقارنتها وفقاً لقيمة (n) وهى عدد ذرات الأكسجين المرتبطة بالذرة المركزية وليس بذرة الهيدروجين الحمضية كالاتي:
(أ) n=0 يكون الحمض ضعيفاً جداً مثل :
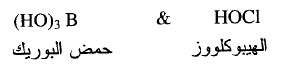
(ب) n=1 يكون الحمض ضعيفاً مثل :

(جـ) n=2 يكون الحمض قوياً مثل :

(د) n=3 يكون الحمض قوياً جداً مثل :

يمكنك قراءة هذا الموضوع من موقع تعرف على علم الكيمياء لفهم كيف تميز بين الحمض القوي والحمض الضعيف
علاقة قوة الحمض بصيغته البنائية Strength of the acid and its Molecular structure