تسمية المركبات الأيونية
عند تسمية المركبات الأيونية اتبع القواعد الخمس الآتية:
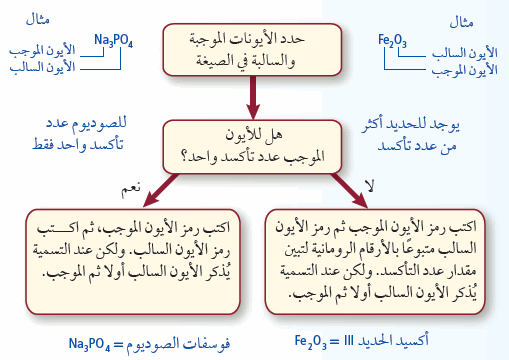
(1) نذكر اسم الأيون السالب أولاً متبوعًا باسم الأيون الموجب. ولكن عند كتابة الصيغة الكيميائية يكتب رمز الأيون الموجب أولاً ، ثم يليه الأيون السالب.
(2) استخدم اسم العنصر نفسه في تسميه أيونه الموجب الأحادي الذرة.
(3) في حالة الأيونات السالبة الأحادية الذرة يشتق الاسم من اسم العنصر مضافًا إلية المقطع (يد) إذا كانت التسمية باللغة العربية و (id) إذا كانت التسمية باللغة الأنجليزية.
(4) في حالة وجود أكثر من عدد تأكسد لعنصر واحد يجب أن تشير إلصيغة الكيميائية إلى عدد تأكسد الأيون الموجب. ويكتب عدد التأكسد بالأرقام الرومانية بين قوسين بعد اسم الأيون الموجبة.
ملاحظة: تنطبق هذة القاعدة على الفلزات الأنتقالية والفلزات في الجهة اليمنى من الجدول الدوري. ولا تنطبق هذة القاعدة على أيونات المجموعتين (1) ، (2) الموجبة لأن لها عدد تأكسد واحداً.
أمثلة:
- يكون أيون +Fe2 وأيون 2-O المركب FeO والمعروف باسم أكسيد الحديد II
- يكون أيون +Fe3 وأيون 2-O المركب Fe2O3 والمعروف باسم أكسيد الحديد III
(5) عندما يحتوي المركب على أيون عديد الذرات نقوم بتسمية الأيون السالب اولاً ، ثم تسمية الأيون الموجب.
أمثلة توضيحية
- كلوريد الصوديوم NaCl Sodium Chloride
- بروميد الصوديوم NaBr Sodium Bromide
- أكسيد الألومنيوم Al2O3 ← Aluminium Oxide
- كلوريد الكوبلت الثنائي CoCl2 ← Cobalt(II) chloride
- هيدروكسيد الصوديوم NaOH ← Sodium Chloride
- كرومات الفضة Ag2CrO4 ← Silver Chromate
- الأنفوجراف التالي يوضح قواعد تسمية المركبات الأيونية:
الأيونات الأحادية الذرية
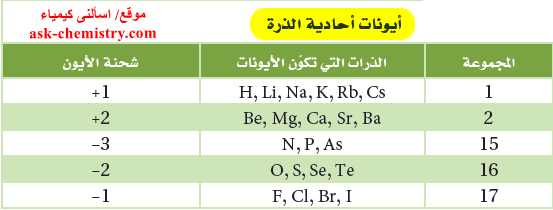
- تتكون المركبات الأيونية الثنائية من أيونات موجبة أحادية الذرة (من الفلز) وأيونات سالبة أحادية الذرة (من اللافلز).
- يتكون الأيون الأحادي الذرة من ذرة عنصر واحدة مشحونة مثل 2+Mg أو -Br
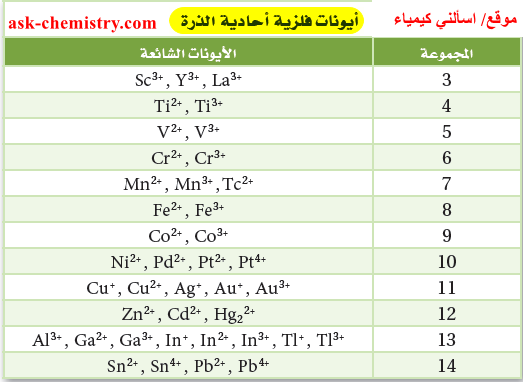
- تبين الجداول التالية شحنة بعض الأيونات الشائعة الأحادية الذرة حسب موقعها فى الجدول الدوري:
المركبات الأيونية الثنائية
- عند كتابة الصيغة الكيميائية لأي مركب أيوني يكتب رمز الأيون الموجب أولاً ، ثم يكتب رمز الأيون السالب.
- توضع أرقام صغيرة أسفل يمين الرمز للتعبير عن عدد أيونات العنصر في المركب الأيوني.
- وإذا لم يكتب رقم صغير إلى جوار الرمز فأننا نعتبر أن عدد الأيونات هو(1).
- ويمكن استعمال أعداد التأكسد لكتابة صيغ المركبات الأيونية بناءاً على ذلك.
- تذكّر أن المركبات الأيونية لا تحمل شحنة كهربائية. لذا عند جمعْ حاصل ضرب أعداد التأكسد يجب أن يكون الناتج صفرًا.
المركبات الأيونية العديدة الذرات
- تحتوي العديد من المركبات الأيونية على أيونات عديدة الذرات، أى الأيونات المكونة من أكثر من ذرة واحدة.
- تبين الجدول التالي قائمة بالصيغ والشحنات الكهربية للأيونات الشائعة عديدة الذرات.

- يسلك الأيون المتعدد الذرات بوصفه وحدة واحدة في المركبات ، وشحنته الكهربائية تساوي مجموعة شحنات الذرات كلها معاً.
- نظراً إلى وجود الأيون المتعدد الذرات بوصفه وحدة واحدة ، فلا يجوز تغيير الأرقام الموجودة أسفل يمين رموز الذرات في الأيون.
- أذا دعت الحاجة إلى وجود أكثر من أيون متعدد الذرات نضع رمز الأيون داخل قوسين، ثم نشير إلى العدد المطلوب بوضع الرقم أسفل يمين القوس من الخارج.
تسمية الأيون الأكسجيني السالب
- الأيون الأكسجينى السالب أيون عديد الذرات ، يتكون غالباً من عنصر لافلزي يرتبط مع ذرة أو أكثر من الأكسجين.
- بعض اللافلزات لها أكثر من أيون أكسجيني ومنها النيتروجين والكبريت. وتسمى هذة الأيونات باستخدام القواعد الآتية:
تسمية الأيونات الأكسجينية السالبة للكبريت والنيتروجين
(1) عليك أن تعرف الأيون الذي يحتوي على أكبر عدد من ذرات الأكسجين. ويشتق اسم هذا الأيون من اسم اللافلز وإضافة المقطع (ات) (ate) إلى آخره.
(2) عليك أن تعرف الأيون الذي يحتوي على أقل عدد من ذرات الأكسجين. ويشتق اسم هذا الأيون من اسم اللافلز وإضافة المقطع (يت) (ite) إلى آخره.

تسمية الأيونات الأكسجينية السالبة للهالوجينات
فيما يلي طرائق تسمية الأيونات الأكسجينية التي تكونها الكلور (وهى نفس الطرق فى حالة الهالوجينات الأخرى):
(1) يشتق اسم الأيون السالب الأكسجينى الذي يحتوي على أكبر عدد من ذرات الأكسجين بإضافة مقطع (بير) (per) عند بداية الاسم ، وإضافة مقطع (ات) (ate) إلى نهاية جذر اللافلز.
(2) يشتق اسم الأيون السالب الأكسجيني الذي يحتوي على عدد من ذرات الأكسجين أقل ذرة واحدة بإضافة مقطع (ات) (ate) إلى نهاية جذر اللافلز.
(3) يشتق اسم الأيون السالب الأكسجيني الذي يحتوي على عدد من ذرات الأكسجين أقل ذرتين بإضافة مقطع (يت) (ite) إلى نهاية جذر اللافلز.
(4) يشتق اسم الأيون السالب الأكسجيني الذي يحتوي على عدد من ذرات الأكسجين أقل من ثلاث ذرات بإضافة المقطع (هيبو) (hypo) ثم المقطع (يت) (ite) إلى نهاية جذر اللافلز.
