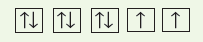(1) مبدأ البناء التصاعدي Auf-bau principle
- كل مستوى طاقة يحتوي على عدد من مستويات الطاقة الفرعية التى تختلف عن بعضها اختلافاً طفيفاً فى الطاقة، لذا يكون الترتيب الحقيقي للطاقة فى الذرة حسب ترتيب مستويات الطاقة الفرعية.
- ينص مبدأ البناء التصاعدي على أنه:
"لابد للإلكترونات أن تملأ المستويات الفرعية ذات الطاقة المنخفضة أولاً ثم المستويات الفرعية ذات الطاقة الأعلي"
- تترتب المستويات الفرعية تصاعدياً كما هو موجود بالشكل التالي:

أهم خواص رسم أوفباو
(1) طاقة المستوىات الفرعية في المستوى الثانوي جميعها متساوية
حيث تجد أن المستوىات الفرعية الثلاثة في المستوى الثانوي 2p جميعها متساوية الطاقة.
(2) في الذرة المتعددة الإلكترونات تكون طاقة المستوىات الثانوية المختلفة ضمن مستوى الطاقة الرئيس الواحد مختلفة.
حيث تجد أن طاقة المستوىات الفرعية الثلاثة في المستوى الثانوي 2p أعلى من طاقة المستوى الفرعي 2s
(3) تسلسل زيادة طاقة المستوىات الثانوية ضمن مستوى الطاقة الرئيسي الواحد هو f,d,p,s.
فإذا كان n=4 فسيكون التسلسل لمستويات الطاقة الثانوية 4f,4d,4p,4s
(4) تستطيع مستويات الطاقة الثانوية لمستوى رئيسي أن تتداخل مع مستويات الطاقة الثانوية ضمن مستوى رئيسي آخر.
حيث تكون طاقة المستوى الفرعي فى المستوى الثانوي 4s أقل من طاقة المستويات الفرعية الخمسة في المستوى الثانوي 3d.
ويمكن تلخيص الفقرات السابقة فى الجدول التالي:

على الرغم من أن مبدأ أوفباو يصف التسلسل الذي تمتلئ فيه المستويات الفرعية بالألكترونات الإ أنه من المهم أن نعرف أن الذرات لا تبنى بإضافة إلكتروناً بعد الآخر.
(2) مبدأ باولي Pauli principle
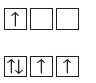
- يمكن تمثيل المستويات الفرعية بمربعات أو دوائر كما يمكن تمثيل الإلكترونات فى المستويات باستخدام الأسهم في المربعات .
- ولكل إلكترون اتجاه دوران مرتبط معه حيث يمثل السهم المتجه لأعلى ↑ دوران الإلكترون في اتجاه معين ، ويمثل السهم المتجه لإسفل ↓ دوران الإلكترون فى الاتجاه المعاكس.
- يمثل المربع الفارغ مستوياً فرعياً شاغراً.
ويمثل المربع الذي يحتوى على سهم واحد متجة لأعلى ↑ مستوياً فرعياً بإلكترون واحد.
ويمثل المربع الذي يحتوى على سهمين أحدهما لإعلى والأخر لإسفل ↑↓ مستوياً فرعياً ممتلئاً بإلكترونين.
- ينص مبدأ باولي على أنه :
" عدد إلكترونات المستوى الفرعي الواحد لا يزيد عن إلكترونين ويدور كلاً منهما حول نفسه باتجاه معاكس للآخر"
- اقترح الفيزيائي النمساوى باولي Pauli هذا المبدأ بعد ملاحظة الذرات في حالات الأثارة. ويمثل المستوى الفرعي الذي يحتوى على زوج من الإلكترونات ذات الدوران المتعاكس.
- ولأن كل مستوى فرعي لا يستطيع احتواء أكثر من إلكترونين فإن الحد الأعلى للإلكترونات في مستوى الطاقة الرئيسي يساوي 2n2
مبدأ باولي للاستبعاد pauli exclusion principle
- ينص مبدأ باولى للاستبعاد على أن :
" لا يتفق إلكترونين في ذرة واحدة في نفس أعداد الكم الأربعة "
- يوضح الجدول التالي اتفاق إلكتروني المستوى الفرعي 3s فى قيم أعداد الكم (ml , l , n) واختلافهما فى قيمتى عدد الكم المغزلي (ms)

(3) قاعدة هوند Hund's law
- تنص قاعدة هوند على أن :
" لا يحدث ازدواج بين إلكترونين في مستوى فرعي معين إلا بعد أن تشغل أوربيتالاته فرادي أولاً"
- إن حقيقة تنافر الإلكترونات المشحونة بشحنة سالبة لها تأثير كبير في توزيع الإلكترونات في مستوىات فرعية متساوية الطاقة.
- وتنص قاعدة هوند على أن الألكترونات تتوزع في المستوىات الفرعية المتساوية الطاقة بحيث تحافظ على أن يكون لها الاتجاه نفسه من حيث الدوران، قبل ان تشغل الإلكترونات الإضافية ذات اتجاه الدوران المعاكس المستويات نفسها.
- على سبيل المثال: تُملأ مستويات (2p) الفرعية الثلاثة بإلكترونات منفردة ، ثم يحدث الأزدواج.
- يوضح الشكل التالي طريقة تسلسل دخول ستة إلكترونات في مستويات (p) الفرعية:
مثال (1): كتابة التوزيع الألكتروني لذرة النتيروجين N7
يكون التوزيع الألكترونى كالتالي:
N7 : 1S2 , 2S2 , 2p3

مثال (2): كتابة التوزيع الألكتروني لذرة النتيروجين O8
- يكون التوزيع الألكتروني كالتالي:
O8 : 1S2 , 2S2 , 2p4