الأيونات الموجبة للفلزات الانتقالية
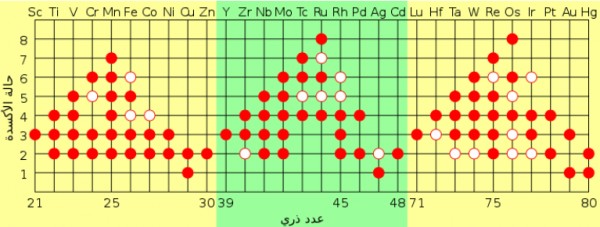
- تذكر أن مستوى الطاقة الخارجي للفلزات الانتقالية هو ns2 وعند الانتقال من اليسار إلى اليمين عبر الدورة تقوم ذرة كل عنصر بإضافة إلكترون إلى المستوى الثانوي (d) .
- عادة ما تفقد الفلزات الانتقالية إلكترونين من إلكترونات التكافؤ لتكون أيونات موجبة الشحنة (+2) وقد تفقد أيضاَ إلكترونات من المستوى (d). لذا تكوّن الفلزات الانتقالية أيونات موجبة ثلاثيةالشحنة (+3) أو حسب عدد إلكترونات المستوى (d) .ولكن من الصعب التنبؤ بعدد الإلكترونات التى يمكن فقدانها.
وعلى سبيل المثال : يكون الحديد أيونات +Fe2+ ،Fe3
- من المؤكد أنّ هذه الفلزات تكوِّن أيونات موجبة ثنائية أو ثلاثية الشحنة.
- على الرغم من أن أن توزيع الإلكترونات الثماني هو التوزيع الإلكتروني للذرة المستقرة الإ أنه يوجد توزيعات أخرى للإلكترونات تزودها ببعض الاستقرار.
على سبيل المثال: تفقد ذرات عناصر المجموعات 11 - 14 إلكترونات لتكون مستوي طاقة خارجياً ذا مستويات ثانوية (هي s ,p , d) .
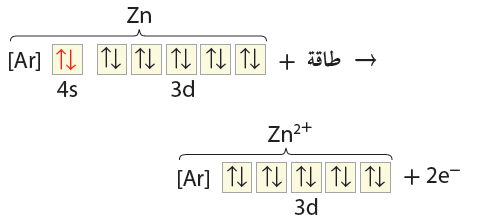
- يبين الشكل التالي التوزيع الألكتروني لذرة الخارصين وعندما تكون ذرة الخارصين الايون الثنائي الموجب تفقد إلكترونين من المستوى 4s وينتج التوزيع الالكتروني المستقر. ويشار إلى هذا التوزيع الإلكتروني المستقر نسبياً بالتوزيع الألكتروني الشبية بالغاز النبيل.
Zn30 : 1s2 2s2 2p6 3s2 3p6 4s2 3d10
Zn+2 : 1s2 2s2 2p6 3s2 3p6 3d10
الشكل التالي يوضح أعدادالأيونات الموجبة التى يمكن أن تكونها الفلزات الأنتقالية