أولاً: الخواص الذرية لعناصر مجموعة الهالوجينات
- تقع عناصر مجموعة الهالوجينات فى المجموعة (17) وتضم : الفلور - الكلور - البروم - اليود.
- لكل عنصر من عناصر المجموعة (17) سبعة إلكترونات تكافؤ وتوزيع إلكتروني ينتهي بــ ns2 np5
- تقل طاقات التأين الأولى والكهروسالبية، كلما انتقلنا إلى أسفل المجموعة (17)

- يعد الفلور العنصر الأكثر كهروسالبية في الجدول الدوري ، لذلك لديه ميل أكبر لجذب الإلكترونات.
- الأستاتين عنصر مشع، ولكن استخداماته غير معروفة.
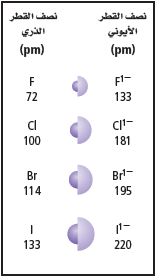
- يزداد نصف القطر الذري ونصف القطر الأيوني كلما انتقلنا إلى أسفل المجموعة.

ثانياً: الخواص الفيزيائية لعناصر مجموعة الهالوجينات
- عند درجة حرارة الغرفة يكون الفلور والكلور في الحالة الغازية. ويكون البروم والزئبق سوائل أما اليود فمادة صلبة تتيامى بسهولة.
- الفلور غاز أصفر باهت. والكلور غاز أصفر مائل إلى اللون الأخضر. أما البروم فسائل أحمر مائل إلى البني. بينما اليود صلب لونه أزرق غامق.
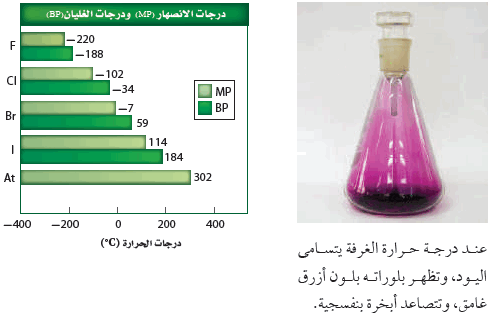
- تزداد درجة غليان ودرجة انصهار عناصر المجموعة 17 كلما زاد العدد الذري.
الاختبارات التحليلية
(1) يمكن تعرف ثلاثة من الهالوجينات من خلال تفاعلات الترسيب، فيتفاعل كل من الكلور والبروم و اليود مع نترات الفضة ليكونوا رواسب مميزة لكل منهم.
كلوريد الفضة : راسب أبيض
بروميد الفضة : راسب حليبي اللون
يوديد الفضة : راسب أصفر
(2) يمكن تعرف الكلور والبروم واليود أيضاً من خلال ذوبانهم في الهكسان الحلقي. فكما هو مبين في الشكل، يتحول المحلول إلى:
اللون الأصفر في حالة الكلور
اللون البرتقالي عند إضافة البروم.
اللون البنفسجي عند إضافة اليود.
