استنتاج قانون كثافة الغاز من القانون العام للغازات
- من القانون العام للغازات المثالية فأن:
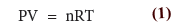
- وبما أن المول (n) يعرف بأنه :
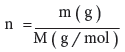
- نعوض عن (n) بالمعادلة (1) لنحصل على:
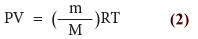
ويمكن كتابتها على الصورة:
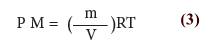
- ومن تعريف الكثافة (ρ):
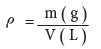
- نعوض عن الكثافة بالمعادلة (3) نحصل على:
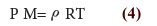
- وبترتيب المعادلة (4) نحصل على المعادلة التالية التي تمثل علاقة رياضية لحساب كثافة الغاز من معرفة الضغط والكتلة المولية عند درجة حرارة معينة .
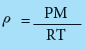
حساب كتلة الغاز
وبنفس الفكرة السابقة نستطيع ايجاد كتلة الغاز او كتلته المولية من المعادلة رقم (3)
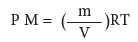
التي يمكن ترتيبها بالشكل الاتي:
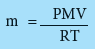
أمثلة محلولة
مثال (1): يستخدم الهيدرازين N2H4 وقوداً للصواريخ . احسب كثافته عند الظروف القياسية (STP)؟
الحل:

الكتلة المولية للـ N2H4 للهيدرازين =
= (2 × 14)+(4 × 1)= 32g/mol
- الظروف القياسية هي ضغط 1atm ودرجة حرارة 273 K لذا:
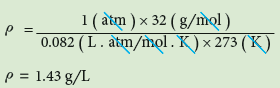
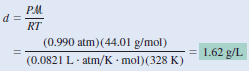
مثال (2): احسب كثافة ثانى أكسيد الكربون CO2 بوحدة g/L عند ضغط 0.99atm ودرجة حرارة 55Co؟
- الكتلة المولية لـ CO2 =
(16 × 2) + 12 = 44g/mol
-تحويل درجة الحرارة من سلزيوس إلى كلفن:
T = 273 + 55 = 328 K
نعوض فى القانون السابق:
يمكن أن يرمز للكثافة بالرمز (ρ) أو الرمز (d)