تعيين ثابت حاصل الإذابة (Ksp) لملح شحيح الذوبان باستخدام قياسات القوة الدافعة الكهربائية للخلية
الغرض من التجربة
تعيين ثابث حاصل الإذابة (Ksp) لكلورريد الفضة AgCl باستخدام القوة الدافعة الكهربائية للخلية.
فكرة التجربة
- باستخدام معادلة نيرنست يمكن تعيين ثابت حاصل الإذابة لكلوريد الفضة AgCl
- يمكن ترميز وتصميم الخلية التالية في حالة تعيين حاصل الإذابة لكلوريد الفضة
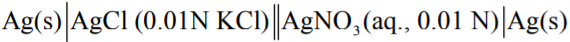
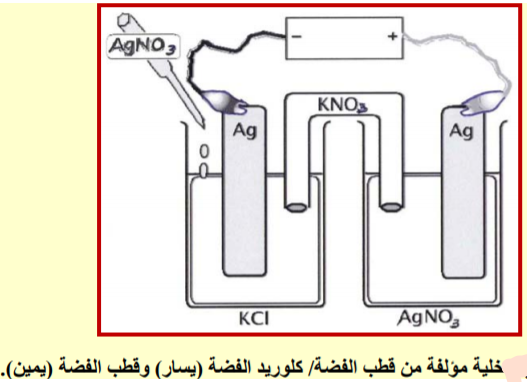
- نجد أن المحلول الذي على يسار التصميم الهندسي يمكن الحصول علية بواسطة إضافة قطرة واحدة من نترات الفضة AgNO3 بواسطة قطارة إلى 0.01M من محلول كلوريد البوتاسيوم KCl
حساب حاصل الإذابة لكلوريد الفضة
- لحساب حاصل الإذابة لكلوريد الفضة AgCl نحتاج إلى معرفة فعالية أيون الفضة (+aAg) وفعالية أيون الكلوريد (-aCl) حيث أن حاصل ضربهما يعطى ثابت حاصل الإذابة.
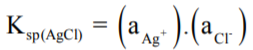
أولاُ: حساب فعالية أيون الفضة
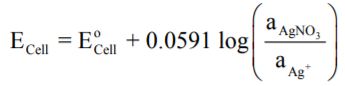
وبما أن القطبين من نفس النوع (معدن الفضة) فأن EoCell = 0 لذلك يمكن أن توضع المعادلة السابقة على الصورة التالية:
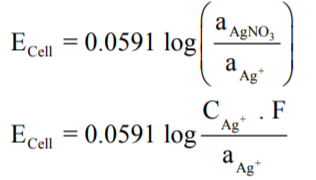
حيث (F) معامل الفعالية .
- ومن الدراسات فأن معامل فعالية أيون الفضة يساوي: FAg+ = 0.892
- تركيز أيون الفضة المولاري يساوي: CAg+ = 0.01M
وبالتعويض عن هذة القيم فى المعادلة الأخيرة نحصل على:

ثانياً: حساب فعالية أيون الكلوريد
لحساب فعالية أيون الكلوريد نكون الخلية ذات الترميز والتصميم الھندسي
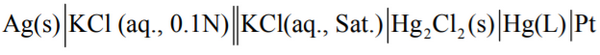
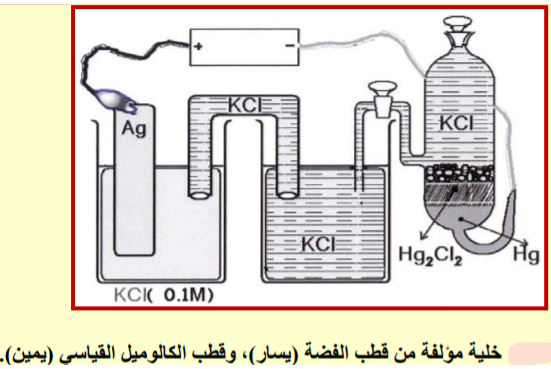
- كما في حساب فعالية أيون الفضة فأنه يمكن حساب فعالية أيون الكلوريد في هذا المحلول باستخدام قطب الفضة/ كلوريد الفضة Ag/AgCl وتطبيق معادلة نيرنست على تفاعله كمايلي:
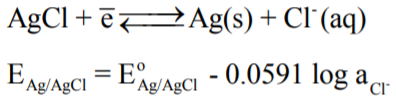
حيث أن قيمة EoAg/AgCl تؤخذ من جدول السلسلة الكهروكيميائية ، بينما قيمة EAg/AgCl تحسب عملياً من الخلية السابقة.
- لحساب قيمة جهد قطب الفضة/كلوريد الفضة EAg/AgCl
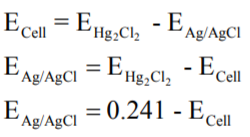
ومن حساب قيمة EAg/AgCl يمكن حساب فعالية أيون الكلوريد على النحو التالي:
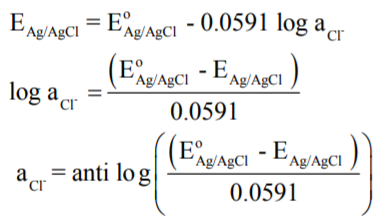
وبهذة الطريقة يمكن تعيين فعالية أيون الكلوريد (باستخدام قطب الكالوميل) باستخدام محلول تركيزه 0.1N من كلوريد البوتاسيوم KCl .
وبمعرفة فعالية أيون كل من الفضة والكلوريد يمكن تعيين حاصل الإذابة:
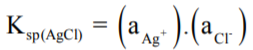
خطوات إجراء التجربة عملياٌ سوف تجدها فى هذا الملف الرائع:
تعيين حاصل الإذابة لملح شحيح الذوبان كهربياً