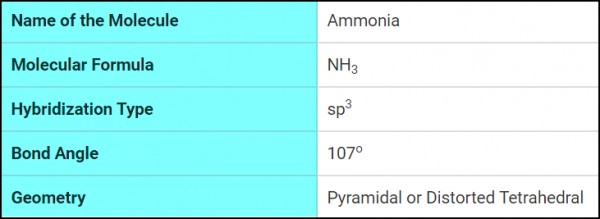
قاعدة التنبؤ بنوع التهجين
- يتم استخدام القاعدة التالية مباشرة لحساب عدد الأفلاك المهجنة فى جزئ ما
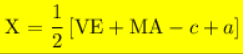
حيث
X = عدد الأفلاك المهجنة
VE = عدد الكترونات التكافؤ للذرة المركزية
MA = العدد الإجمالي للذرات / المجموعات أحادية التكافؤ المحيطة بالذرة المركزية.
C =عدد الشحنات الموجبة على الكاتيون إذا كان النوع المعطى كاتيون متعدد الذرات
a = عدد الشحنات السالبة على الأنيون إذا كان النوع المعطى أنيون متعدد الذرات
ملاحظات هامة :
MA = العدد الإجمالي للذرات / المجموعات أحادية التكافؤ فقط المحيطة بالذرة المركزية حيث تكون MA للذرات ثنائية التكافؤ = صفر
- غالباُ تكون الذرة المركزية هى أقل الذرات الموجودة في السالبية كهربية
- من القاعدة السابقة أذا كان:
X = 2 ← عدد الاوربتالات المهجنة = 2 ← نوع التهجين sp
X = 3 ← عدد الاوربتالات المهجنة = 3 ← نوع التهجين sp2
X = 4 ← عدد الاوربتالات المهجنة = 4 ← نوع التهجين sp3
X = 5 ← عدد الاوربتالات المهجنة = 5 ← نوع التهجين sp3d
X = 6 ← عدد الاوربتالات المهجنة = 6 ← نوع التهجين sp3d2
X = 7 ← عدد الاوربتالات المهجنة = 7 ← نوع التهجين sp3d3
فى جزئ النشادر NH3 يكون:
- الذرة المركزية هنا هي ذرة النيتروجين
VE = 5 لأن عدد الكترونات التكافؤ للنيتروجين = 4
N6 : 1s2 , 2s2 2p3
MA = 3 لأن ذرات الهيدروجين الثلاثة ذرات أحادية التكافؤ
c = 0 , a = 0 لأنه لا يوجد فى المركب شحنات موجبة أو شحنات سالبة (أنيون أو كاتيون)
X= ? , MA = 5 , VE = 3 , c = 0 , a = 0
[ X = 1/2 [ 5 + 3 - 0 + 0
X = 4
وعلى ذلك يكون التهجين فى جزئ النشادر من النوع Sp3 والشكل الهندسي رباعي السطوح Tetrahedral
شرح التهجين فى جزئ الأمونيا NH3
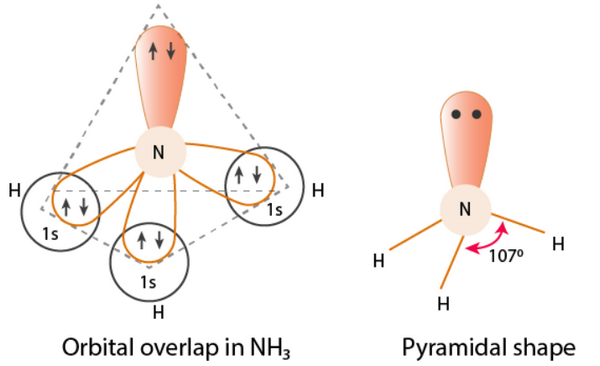
- التوزيع الإلكترونى لذرة النيتروجين: 1s2, 2s2, 2px1, 2py1, 2pz1
- تحتوى ذرة النيتروجين على ثلاث أوربتالات للترابط وهي: 2px1, 2py1, 2pz1 حيث تكون ثلاث روابط سيجما عند التداخل مع ثلاث أوربتالات من النوع 1S لثلاث ذرات هيدروجين.
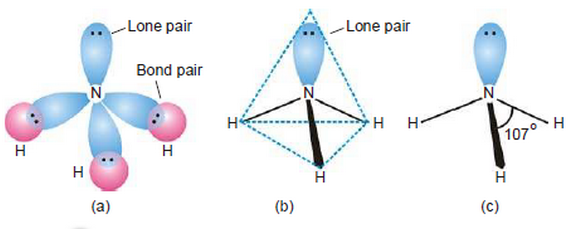
- نجد أن الأربع ذرات المكونة لجزئ النشادر لا تكون فى مستوى واحد ولكن تكون هرم ثلاثى تكون فيه قاعدة الهرم مكونة من ثلاث ذرات هيدروجين وتكون ذرة النيتروجين فى قمة الهرم.
- وجد بالتجربة أن الزواية بين الروابط فى جزئ النشادر 107o وذلك بسبب:
(أ) التهجين من النوع sp3 فى جزئ الأمونيا.
(ب) تنافر زوج الألكترونات الموجود على ذرة النيتروجين electron pair interactions
(1) شرح التهجين من النوع sp3
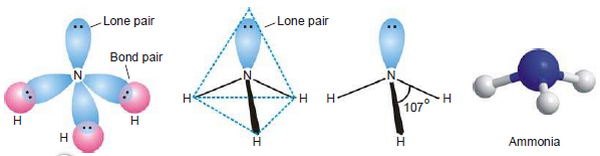
- يحدث التهجين بين اوربتالات التكافؤ لذرة النيتروجين المركزية (2s2, 2px1, 2py1, 2pz1) قبل حدوث التداخل مع الاوربتال 1s للهيدروجين.
- حيث تتكون أربعة اوربتالات مهجنة جديدة (اوربتال واحد من هؤلاء الأربعة يحتوى على زوج من الألكترونات والثلاث الآخرين يحتوى كلاً منهما على الكترون مفرد جاهزة للتداخل وتكوين روابط). ويكون التهجين من النوع sp3 ويكون شكل المركب رباعي السطوح Tetrahedral وتكون الزاوية بين الاوربتالات المهجنة 109.5o.
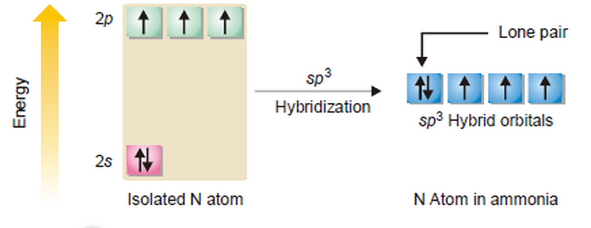
- بعد عملية التهجين التى تمت داخل ذرة النيتروجين ، تتداخل ثلاث اوربتالات 1s لثلاث ذرات هيدروجين مع الثلاث اوربتالات المهجنة على ذرة النيتروجين لتكوين ثلاث روابط سيجما.
- وجد عن طريق التجربة ان الزاوية بين الروابط فى الشكل الرباعي السطوح تكون 107o وليس 109.5o وذلك بسبب تنافر زوج الالكترونات الحر الموجود على ذرة النيتروجين electron pair interactions.
(2) تنافر زوج الالكترونات الحر
- تحتوى ذرة النتيروجين المركزية فى غلاف تكافؤها على ثلاث أزوج ترابط مع ثلاث ذرات هيدروجين وأيضاً وجود زوج حر من الالكترونات على ذرة النيتروجين.
- تترتب الثلاث ازواج الرابطة بالاضافة إلى الزوج الحر فى شكل رباعي السطوح tetrahedral حول الذرة المركزية.
- زوج الالكترونات الحر يكون كثافة الكترونية عالية حوله فيزداد التنافر بينه وبين أزواح الروابط N-H ويجبرهم على الاقتراب من بعضهم لتكوين شكل رباعي السطوح وتكون الزاوية 107o بدلاً من 109.5o
- لذلك يمكن القول أن الشكل الهندسي لجزئ الأمونيا هو هرم ثلاثي Trigonal pyramidal أو رباعى السطوح مشوه Distorted tetrahedral
الخلاصة