عدد الكم المغزلي (Spin quantum Number (ms
- لا يتسع أى أوربتال لأكثر من إلكترونين يدور كل منهما حول محوره ، وذلك أثناء دورانه حول النواة.
- ويمكن تخيل ذلك لو تصورنا دوران الأرض حول نفسها أثناء دورانها حول الشمس.
- وبالرغم من أن إلكتروني الأوربتال الواحد يحملان نفس الشحنة السالبة فقد يتبادر إلى الذهن أنهما يتنافران ، الإ أن ما يحدث فعلاُ هو أنه نتيجة لدوران الألكترون حول محوره في إتجاه معين يتكون مجال مغناطيسي يعاكس اتجاة المجال المغناطيسي الناشي عن دوران الألكترون الآخر حول محوره. ويقال أن الإلكترون فى حالة إزدواج Paired ، ويرمز لذلك بالرمز (↑↓)
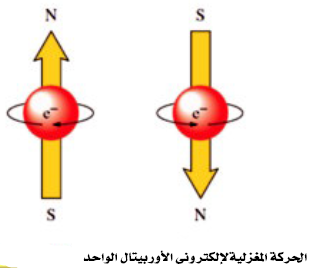
- يحدد عدد الكم المغزلي (ms) نوعية حركة الألكترون المغزلية فقد تتخذ الحركة اتجاة عقربي الساعة (↑) وتكون قيمة (ms) له (1/2+) أو عكسها (↓) وتكون قيمة (ms) له (1/2-)
- طبقا لمبدأ استبعاد باولي Pauli exclusion principle يتخذ الإلكترونان في مثل هذا المدار قيمتين متضادتين للعدد الكم المغزلي، تلك القيمتين هما -1/2 و +1/2. أي أنه إذا شغل إلكترونان نفس مستوى طاقة في الذرة فإن أحدهما يتخذ عدد كم مغزلي +1/2، ولا بد أن يتخذ الآخر عدد الكم المغزلي -1/2.
وعلى ذلك فأن:
مجموع عدد الكم المغزلى لإلكترونى الاوبيتال الواحد = (1/2-) + (1/2+) = صفر