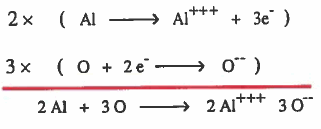الرابطة الأيونية The Ionic Bond
- تعريف الرابطة الأيونية: هي رابطة ناتجة عن انتقال الإلكترونات كليا من ذرة إلى أخرى في المركبات الكيميائية.
- أو هي رابطة ناتجة عن تجاذب بين أيـون مـوجب ( ذرة تفقد إلكترون أو اأكثر) وأيون سالب ( ذرة تكتسب إلكترون أو أكثر) .
شروط (العوامل التي تؤدي إلى) تكون الرابطة الأيونية
تتكون الرابطة الأيونية بين عنصرين:
(۱) عنصر فلزي والذي جهد تأينه منخفض ( سالبيته الكهربية منخفضة) ويمثله معادن المجموعة (1A , 2A)
(۲) عنصر لافلزي وتكون الألفة الإلكترونيـة له مرتفعة ( سالبـيـتـه الكهربية مرتفعة) ويمثله عناصر المجموعة ( 6A , 7A).
العلاقة بين الخاصية الأيونية والفرق في السالبية الكهربية
تتكون الرابطة الأيـونـيـة بـين العنصـرين عنـد وجـود فـرق كـبـيـر فـي السـالـبـيـة الـكـهـربـيـة بين العنصرين المتحدين ، وتزداد قـوة الرابطة الأيونيـة بازدياد الفرق في السالبية الكهربية بين الذرتين المرتبطتين .
مثال : ترتب قوة الرابطة الأيونية : Li-F > Na-O > Ca-O
وسبب ذلك أن الفرق في السالبية الكهربية بين Li-F > Na-O > Ca-O
العلاقة بين الخاصية الأيونية وطاقة الشبكة البلورية
- تتكون الرابطة الأيـونيـة عنـد تـوفـر طـاقـة الشبكة البلورية.
- وكلمـا كـانـت قـيـمـة طـاقـة الشـبكة البلورية عالية ، تزيد من قوة الرابطة الأيونية .
- تعريف طاقة الشبكة البلورية : هي الطاقة اللازمة لفصل مول واحد من المركب الأيوني الصلب إلى أيونات منفصلة في الحالة الغازية
مثال:

المركب الذي يحتوي على رابطة أيونية يسمى مركب أيوني
- تعريف المركب الأيوني: هو مركب يحتوي على شبكة بلورية أيونية ، وهذه الشبكة تتكون من أيونات موجبة (cation) وأيونات سالبة (anion) بحيث تكون قوى التـجـاذب أكبر ما يمكن ، وقوى التنافر أقل ما يمكن.
كيف تتكون الرابطة الأيونية
(1) تفقد أحـدى الـذرتين إلكترون أو أكثر من إلكترونات التكافؤ لتتحول إلى أيون موجب (کاتیون cation)
(2) تكسب الذرة الأخرى إلكترون أو أكثر في مجال التكافؤ فيهـا لتتحول إلى أيـون سالب (أنیون anion) .
(3) يتم الترابط بين الأيون الموجب والأيون السالب نتيجة للتجاذب الكهربي.
ملاحظة: نلاحظ وجـود الرابطة الأيونية غالباً بين (عناصر المجموعة الأولى أو الثانية) وبين (عناصر المجموعة السادسة أو السابعة) .
الرابطة الأيونية ناتجة عن تجاذب بين أيونات موجبة وأيونات سالبة
- تتكون الأيونات الموجبة من الذرات التي تميل إلى فقد الإلكترونات مثل:
ليـثـيـوم(+Li) ، صودیوم (+Na) بوتاسـيـوم (+K) ، روبینیوم (+Rb) ، مغنيسيوم (++Mg) ، كالسيوم (++Ca) ، باريوم (++Ba) ، آلومينيوم (+++Al) .
- تتكون الأيونات السالبة من بعض الذرات التي تميل إلى اكتساب الإلكترونات مثل:
فلورید (-F) ، کلورید (-Cl) ، برومید ( -Br) ، یودید (-I) ، أکسید (--O) ، كبريتيد (--S)
أمثلة على كيفية تكون الرابطة الأيونية
مثال (1): الرابطة الأيونية في كلوريد الصوديوم (NaCl)
(1) تفقد ذرة الصوديوم (Na) إلكترون واحد ليتكون ايون الصوديوم الموجب (+Na) .
(2) تکسب ثرة الكلور (Cl) إلكترون واحد ليتكون أيون الكلور السالب (-Cl) .
(3) يتم الترابط بين أيون الصوديوم الموجب وأيون الكلور السالب نتيجة للتجاذب الكهربي.
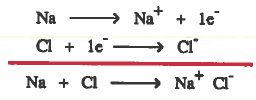
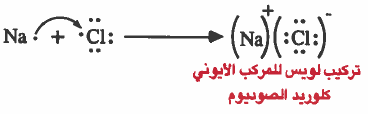
ملاحظة: يمكن توضيح كيفية انتقال الإلكترونات في المركب الأيوني باستخدام رموز لويس:
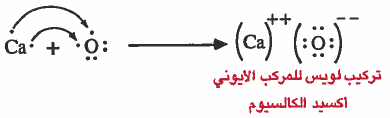
مثال (2): الرابطة الأيونية في أكسيد الكالسيوم (CaO)
(1) تفقد ئرة الكالسيوم (Ca) إلكترونين ليتكون ايون الكالسيوم الموجب (++Ca).
(2) تکسب ذرة الأكسجين (O) إلكترونين ليتكون ايون الأكسجين السالب (--O).
(3) يتم الترابط بين أيون الكالسيـوم الموجب وأيون الاكـسـجين السـالـب نـتـيـجـة للـتـجـاذب الكهربي.
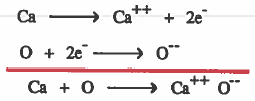
ملاحظة: يمكن توضيح كيفية انتقال الإلكترونات في المركب الأيوني باستخدام رموز لويس:
مثال (3): الرابطة الأيونية في كلوريد الكالسيوم (CaCl2)
(1) تفقد ذرة الكالسيوم (Ca) إلكترونين ليتكون ايون الكالسيوم الموجب (++Ca) .
(2) تکسب ذرة الكلور (Cl) إلكترون واحد ليتكون ايون الكلور السالب ( -Cl) .
(3) يتم الترابط بين أيون کالسیوم موجب وأيونين کلور نتيجة للتجاذب الكهربي .
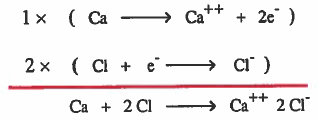
مثال (4): كيفية تكون الرابطة الأيونية في أكسيد الألومينيوم (Al2O3)
(1) تفقد ذرة الألمنيوم (Al) ثلاثة إلكترونات ليتكون ايون الألمنيوم الموجب (+++Al) .
(2) تكسب نرة الأكسجين (O) إلكترونين ليتكون ايون الأكسيد السالب (--O) .
(3) يتم الترابط بين أيونين من الكالسيوم و 3 أيونات اكسجين نتيجة للتجاذب الكهربي.