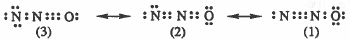أمثلة على أشكال الرنين
مثال (1): ما الاشكال الرنينية للجزيء SO3
الحل:
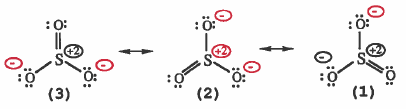
ويمكن توضيح طريقة الحل كما يلي:
يمكن الحصول على الأشكال الرنينية السابقة بإيجاد تراكيب لويس الممكنة كما يلي :
8O: 1s² 2s² 2p4
لذلك الأكسجين يقع في المجموعة (6A)
16S: 1s2 2s2 2p6 3s23p4
لذلك الكبريت يقع في المجموعة (6A)
لذا فأن عدد إلكترونات التكافؤ = 6 + ( 3 × 6) = 24 إلكترون
نضع زوج من الإلكترونات بين كل ذرتين مرتبطتين:
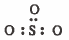
نوزع الإلكترونات المتبقية (18) على الذرات المحيطة بالذرة المركزية (S):

وحيث أنه يوجد (6 إلكترونات) حول الذرة المركزية (S) أي اقل من ثـمـانـي إلكترونات فإننا نأخذ زوج إلكتروني واحد غير رابط من أحد ذرات الأكسجين الثلاث لتكون رابطة ثنائية ونتيجة لذلك سوف تظهر ثلاثة صيغ بنائية ممكنة كما يلي :
وللتأكد من صحة الأشكال الرنينية نكتب الشحنة الاسمية لكل ذرة باستخدام القانون :
الشحنة الاسمية للذرة = رقم المجموعة - عدد الإلكترونات الحرة - عدد الروابط
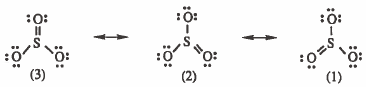
مثال (2): ما الأشكال الرنينية للجزيء SO2
الحل:

ويمكن توضيح طريقة الحل كما يلي:
يمكن الحصول على الأشكال الرنينية السابقة بإيجاد تراكيب لويس الممكنة كما يلي :
8O: 1s² 2s² 2p4
لذلك الأكسجين يقع في المجموعة (6A)
16S: 1s2 2s2 2p6 3s23p4
لذلك الكبريت يقع في المجموعة (6A)
لذا فأن عدد إلكترونات التكافؤ = 6 + ( 2 × 6) = 18 إلكترون
نضع زوج من الإلكترونات بين كل ذرتين مرتبطتين:
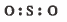
نوزع الإلكترونات المتبقية (14) على الذرات المحيطة بالذرة المركزية (S) والمتبقي يوضع على الذرة المركزية:

وحيث أنه يوجد (6 إلكترونات) حـول الذرة المركزية (S) أي أقل من ثماني إلكترونات فإننا نأخذ زوج إلكتروني واحـد غـيـر رابط من أحـدى ذرات الأكسجين لتكوين رابطة ثنائية ونتيجة لذلك سوف تظهر لنا صيغتان بنائيتان كما يلي:

وللتأكد من صحة الأشكال الرنينية نكتب الشحنة الاسمية لكل ذرة باستخدام القانون :
الشحنة الاسمية للذرة = رقم المجموعة - عدد الإلكترونات الحرة - عدد الروابط
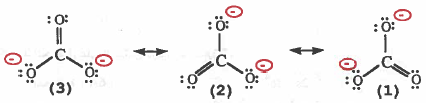
مثال (3): ما الأشكال الرنينية لأيون الكربونات --CO3
الحل:
مثال (4): ما الأشكال الطنينية لجزيء أكسيد النيتروز N2O
الحل :
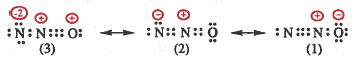
لاحظ أن الشكل رقم (3) غير مرغوب فيه لوجـود شـحـنـات مـوجـبة على ذرتين متجاورتين
كيفية الحصول على الأشكال الرنينية السابقة .
يمكن الحصول على الأشكال الرنينية السابقة بإيجاد تراكيب لويس الممكنة كما يلي :
7N: 1s2 2s2 2p3
لذلك الكبريت يقع في المجموعة (5A)
8O: 1s² 2s² 2p4
لذلك الأكسجين يقع في المجموعة (6A)
لذا فأن عدد إلكترونات التكافؤ = 6 + ( 2 ×5) = 16 إلكترون
نضع زوج من الإلكترونات بين كل ذرتين مرتبطتين:
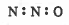
نوزع الإلكترونات المتبقية (12) على الذرات المحيطة بالذرة المركزية (N):
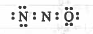
وحيث انه يوجد (4 إلكترونات) حـول الذرة المركزية (N) أي أقل من ثماني إلكترونات فإننا نأخذ زوجين إلكترونين غير رابطين من الذرات المجاورة ونتيجة لذلك سوف تظهر لنا الصيغ البنائية التالية: