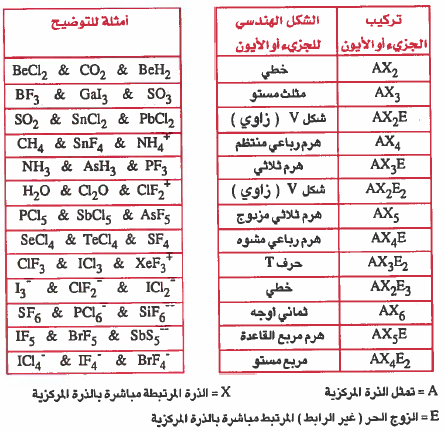
أشكال الجزيئات Molecular Shapes
الصورة السابقة للرابطة التساهمية والتي كنا نعبر عنها بزوج من الإلكترونات يوجد بين الترتين المرتبطتين ، لـم تـعـتـبـر كـافـيـة للتعرف على الشكل الهندسي للجـزيئـات التساهمية. ولذلك ظهرت الكثير من النظريات التي تحاول ان تفسير الرابطة التساهمية مثل:
هناك عدد كبير من المركبات الموجودة في الواقع ، ولكن ولحسن الحظ فإن الأشكال الهندسية التي تتخذها محدودة ، وقد وجد أن هناك خمسة أشكال هندسية يمكن اعتبارها مجموعة أساسية ، ويتم اشتقاق اشكال الجزيئات الأخرى منها .
وهذه الأشكال الأساسية تمتاز بعدم احـتـواء الذرة المركزية على أزواج إلكتـرونـيـة غـيـر رابطة ( حـرة ) ، لأن وجـود الأزواج غير الرابطة يزيد من تعقيد شكل الجزيء . وبالتالي فإن الأشكال الأساسية للجزيئات عديدة الذرات والتي تحتوي على أزواج رابطة فقط هي كما يلي :
(1) خطي Linear
- هذا الشكل يحتوي على ثلاث ذرات AX2 جميعها في خط مستقيم.
- وتكون زاوية الرابطة فيها تساوي °180 .
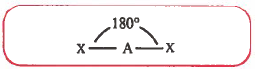
(2) مثلث مستو ( المستوي المثلثي ) Planar triangular
- هذا الشكل يحتوي على أربع ذرات AX3 جميعها في مستوى واحد.
- تكون هذه الذرات في أركان مثلث ، والذرة المركزية تكون في مركز المثلث.
- تكون زاوية الرابطة بينها تساوي 120°
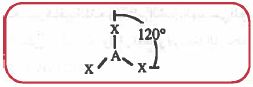
(3) هرم رباعي السطوح ( هرم رباعي الأوجه المنتظم ) Tetrahedral
- الهرم رباعي السطوح هو عبارة من هرم ذو قاعدة مثلثية ويحتوي على أربعة أوجه ، كل وجه عبارة عن مثلث متساوي الاضلاع.
- هذا الشكل يحـتـوي على خمس ذرات AX3
- الذرة المركزية توجـد فـي مـركـز الـهـرم والذرات الأربعة تتواجد في أركان هذا الهرم.
- تكون زاوية الرابطة بينها تساوي °109.5
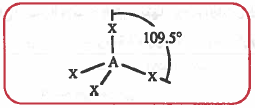
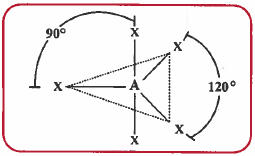
(4) هرم ثلاثي مزدوج (ثنائي الهرمية المثلثي) Trigonal bipyramid
- الهرم الثلاثي المزدوج هو عبارة عن هرمين علوي وسفلي يشتركان بقاعدة مثلثية (مثلث متساوي الأضلاع) ويحتوي على ستة أوجه ، كل وجه عبارة عن مثلث.
- هذا الشكل يحتوي على ست ذرات ، الذرة المركزية توجد في وسط القاعدة المثلثية المشتركة والذرات الخمس الباقية تتواجد في أركان هذا الشكل ، وفي هذه الحالة فإن زاوية الرابطة غير متساوية ، فهي تحتوي على نوعين من الزوايا:
- زاوية الرابطة بين الذرات المتجاورة الموجودة في المثلث المشترك °120
- زاوية الرابطة بين الذرة المحورية والمحيطية °90 .
(5) ثماني أوجه منتظم ( ثماني السطوح ) Octahedral
- هذا الشكل هو عبارة عن هرمين علوي وسفلي يشتركان بقاعدة مربعة ويحتوي على ثمانية أوجه ، وبالتالي يصبح لدى هذا الشكل ستة رؤوس .
- هذا الشكل يحتوي على سبع ذرات ، الذرة المركزية توجد في وسط القاعدة المربعة المشتركة والذرات الست الباقية تتواجد في أركان هذا الشكل ، وفي هذه الحالة فإن زاوية الرابطة غير متساوية ، فهي تحتوي على نوعين من الزوايا:
- زاوية الرابطة بين الذرات المتجاورة 900
- زاوية الرابطة بين الذرات المتقابلة °180
كيفية تحديد الشكل الهندسي المناسب للجزيء أو الأيون
(1) يجب أولاً رسم تركيب لويس.
(2) من تركيب لويس يتم تحديد عدد الأزواج الإلكترونية حول الذرة المركزية. وعـدد الأزواج غـيـر الرابطة (الحرة) الموجودة على الذرة المركزية.
(3) تعامل الرابطة الثنائية والثلاثية معاملة الرابطة الأحادية.
(4) انظر للجدول التالي الذي على اليمين وبناء على ذلك حدد الشكل المناسب
مـثـال : إذا تبين من تركيب لويس أن الذرة المركزية (A ) مرتبطة بثلاث ذرات (3X) وزوج غير رابط (E) فإن الشكل الهندسي المناسب هو (هرم ثلاثي) . وهكذا ....