نوع التهجين في النشادر NH3
(1) تكتب التركيب الإلكتروني لذرة النيتروجين في الحالة المستقرة:
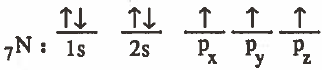
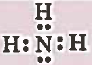
تركيب لويس لجـزئ NH3 هو
نلاحظ ان حـول الذرة المركزية أربعـة ازواج إلكترونية، فإنه حسب نظرية (VSEPR) سوف تتوزع الأزواج الإلكترونية في أركان هرم رباعي السطوح.
وهذا يعني أن التهجين من نوع sp3
وبذلك فنحن في حاجة إلى أربعة مدارات متساوية في الطاقة، بحيث يكون ثلاثة مدارات منها يحتوي كل منها على إلكترون منفرد.
ملاحظة: في هذه الحالة لن تحتاج إلى نقل إلكترون لأنه متوفر لدينا ثلاثة إلكترونات مفردة.
(2) تحدث عملية دمج بين ثلاث مجالات من (p) والمجال (2s) لينتج أربع مجالات مهجنة متساوية في الشكل والطاقة ويرمز لكل منهما (sp3)
ويحتوى كل منها على إلكترون منفرد فيما عدا مدار واحد يحتوي على زوج إلكتروني غير رابط (حر).
التركيب الإلكتروني لذرة الكربون في بعد التهجين:
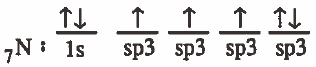
(3) يحدث تداخل بين مجال (1s) من ذرة الهيدروجين وثلاث مجالات من (sp3) المهجن من ذرة النيتروجين لتتكون ثلاث روابط تساهمية.
وهذه الروابط متساوية في الشكل والطاقة أما المدار الرابع فيحتوي على زوج من الإلكترونات الحرة.
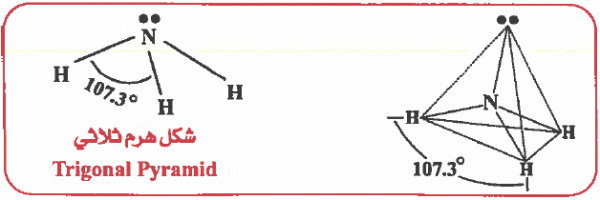
وحيث أن الزوج الإلكتروني غير الرابط أكثر طاقة من الزوج الرابط لذا فإنه يشغل حيز أكبر في الفراغ وبالتالي سوف يزداد التنافر بين إلكترونات الزوج الحر وإلكترونات الأزواج الرابطة وبالتالي تقل الزاوية بين أي رابطتين في النشادر عن مـا هـو مـوجـود في الميـثـان (°109.5) لتـصـبح الزاويةHNH حوالي. (107.3o)
وحيث أن المركب ينتمي إلى النوع (AX3E) ، إذن الشكل الهندسي للـجـزيء هو هرم ثلاثي (Trigonal Pyramid)
من الأمثلة المشابهة للنشادر NH3 في التهجين والشكل الهندسي:
NF3 & PF3 & PC13 & AsH3