ثالثاً/ قوى لندن London Forces
- وجد عملياً ان الغازات النادرة مثل الهيليوم He والجزيئات غير القطبية مثل: O2 , N2 , C2H4 , CCl4 , C6H6 يمكن تحويلها إلى الحالة السائلة إذا خفضت درجة حرارتها ، وهذا يدل على وجود قوی تجاذب بينها سميت قوی لندن.
- القوى التي تربط الذرات غير المتحدة والجزيئات الغير قطبية المتعادلة كهربياً مع بعضها البعض تسمی قوی لندن London Forces نسبة إلى الفيزيائي الألماني London الذي قـام بـتـفسيـرهـا .
- وتسمى هذه القـوي أيضاً بقـوى التشتت Dispersion Forces .
- وتوجد هذه القوى في السوائل والجوامد أيضاً.
ملحوظة هام : كلما زادت قوى التجاذب بين الجزيئات يقل الضغط البخاري وتزداد درجة الغليان
كيفية نشوء قوى لندن بين الجزيئات
- عندما تتحرك الإلكترونات حول الذرة او الجزيء فإنها تتحرك بشكل عشوائي ، وفي لحظة ما هناك احتمال وجود عدد أكبر من الإلكترونات في أحد طرفي الذرة أكثر مما في الطرف الآخر مما يؤدي إلى تكون وضع يشبه الجزيئات القطبية ، وهذه القطبية المؤقتة تؤثر على الذرات أو الجزيئات المجاورة فتنشيا جزيئات مستقطبة ونتيجة لذلك ينشأ تجاذب بين الجزيئات المستقطبة في لحظة وجودها ، وهذه القوى تسمي قوى لندن.
- وهذه القوى تكون عادة ضعيفة (علل) وذلك بسبب وجودها السريع الزوال.
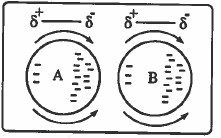
لاحظ من الرسم أنه عندما يحدث استقطاب في الذرة A فإنه يؤدي إلى حدوث استقطاب في الذرة المجاورة B
كلما زاد حجم الجزيء (العدد الذري) تزداد قوى لندن ، فالجزيئات الثقيلة أكبر تجاذباً من الجزيئات الخفيفة ، وبالتالي أقل في الضغط البخاري وبالتالي أعلى في درجات الغليان.
كلما زاد الوزن الجزيئي للجزيء تزداد قوى لندن .
تزداد قوى لندن بازدياد العدد الذري (عدد الإلكترونات) وذلك للأسباب التالية:
(1) الجزيئات الكبيرة تحتوي على عدد أكبر من الإلكترونات مما يجعل الحصول على أقطاب لحظية أسهل وأكثر حدوثاً.
(2) بعد الإلكترونات عن النواة وضعف قوى التجاذب معها في الجزيئات الكبيرة فإن هذا يؤدي إلى زيادة حـركـة الإلكترونات الـعـشـوائية مما يزيد من احـتـمـال حـدوث عـمـليـة الاستقطاب اللحظية.
- نستنتج من ذلك ان زيادة عدد الذرات في الجـزيء الواحـد يزيد من عـدد الإلكترونات وبالتالي تزداد مواضع الاستقطاب ، وبذلك تزداد قوى لندن.
- أمثلة التجاذب بين جزيئات الهكسان (C6H14) أعلى من الـتـجـاذب بين الإيثان (C2H6) ، وبالتالي فالضغط البخاري للهكسان أقل ودرجة غليانه أعلى.
وكذلك درجة غليان الكلور (Cl2) أعلى من النيتروجين (N2) .
- ملاحظة: قوى لندن موجودة في جميع الجزيئات قطبية أو غير قطبية وكذلك بين الأيونات ،وذلك لأن جـمـيع الـجـزيـئـات تحـتـوي على إلكترونات ، لكن هذه الـقـوى هي القـوى الـوحـيـدة الموجودة بين الجزيئات غير القطبية.
أسئلة وأجوبة على قوى التجاذب بين جزئيات السائل؟
س1: ما أنواع القوى بين الجزيئات في المواد التالية: CO2 , C2H6 , Ar , HF , HCl ؟
الحل:
- HCl ثنائي القطب - لنائي القطب وكذلك قوى لندن.
- HF روابط هيدروجينية.
- Ar قوی لندن.
- C2H6 قوی لندن.
- CO2 قوی لندن.
س2: قارن بين كل جزيئين من حيث درجة الغليان مع ذكر السبب؟
الحل:
- درجة غليان Ne > He وذلك لأن العدد الذري (الحجم الذري) لـ Ne اكبر من He.
- درجة غليان H2O > NH3 وذلك لسببين:
- لأن عدد الروابط الهيدروجينية في H2O اكثر من NH3
- الرابطة الهيدروجينية بين (H - O) أقوى من الرابطة بين (N-H)
- درجة غليان SO2 > CO2 وذلك لأن SO2 قطبي أمـا CO2 غير قطبي، وأيضاً قـوى لندن في SO2 أقوى من CO2
س3: أي المركبات التالية يحتوي بين جزيئاته على قوى ثنائية القطب: CO2 , F2 , H2S , CH4 ؟
الحل: H2S
س4: فما الصفات الواجب معرفتها للمركبات عند مقارنة درجات غليانها؟
الحل: القطبية - الروابط الهيدروجينية - الوزن الجزيئي
س4: ما أثر استبدال ذرة الهيدروجين بذرة فلور في مركب C2H6 على درجة الغليان؟
الحل: تزداد درجة الغليان والسبب هو أن المركب C2H6 غير قطبي وعند إدخال ذرة الفلور يصبح المركب C2H5F قطبي وبذلك تزداد درجة غليانه.
س5: ما نوع القوى السائدة في المركبات التالية وأيها أعلى في درجة الغليان . CH4 , C2H6 , C3H8 , C4H10 ؟
الحل: القـوى السائدة هي قـوى لندن ، والمركب الأعلى في درجـة الـغلـيـان هو C4H10 وذلك لأن الوزن الجزيئي له أكبر.
س6: ما أثر زيادة التجاذب بين الجزيئات على الخصائص التالية: درجة الغليان ، الضغط البخاري ، حرارة التبخر ؟
الحل: درجة الغليان ( تزداد ) ، الضغط البخاري ( يقل ) ، حرارة التبخر ( تزداد )