المحاليل Solutions
- تعريف المحلول : هو مزيج متجانس من المذاب والمذيب ، بحيث لا يحدث تفاعل بينهما .
- ويمكن أن توجد المحاليل في حالة غازية أو سائلة أو صلبة .
أولاً/ أنواع المحاليل حسب حالتها الفيزيائية

سؤال: كيف يمكن تحديد المذاب Solute والمذيب Solvent في المحاليل؟
ج: إذا كان المحلول يتكون من غاز او صلب في سائل تكون المادة السائلة هي المذيب . أما إذا كان المحلول مكون من مواد سائلة فإن الموجود بنسبة أكبر يكون هو المذيب.
ثانياً/ أنواع المحاليل حسب نسبة المذاب
وهناك تقسيمات أخرى للمحاليل فمثلاً:
يمكن تقسيم المحاليل إلى :
(1) محاليل مخففة (Dilute Solution)
هي التي تكون فيها نسبة المذاب إلى المذيب قليلة
(2) محاليل مـركـزة (Concentrated Solution)
هي التي تكون فـيـهـا نسـبـة المذاب إلى المذيب كبيرة
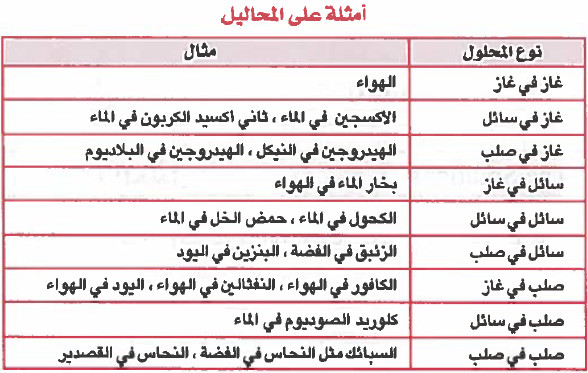
ثالثاً/ أنواع المحاليل حسب التشبع
- يمكن تقسيم المحاليل إلى:
(1) محلول مشبع Sturated Solution
هو أقصى كـمـيـة من المذاب التي يمكن أن تنوب في كمية معينة من المذيب عند درجة حرارة معينة. وفي هذه الحالة يكون المحلول في حالة اتزان ديناميكي مع الجزء غير المذاب (الراسب).
ملاحظة : يصل المحلول إلى حالة التشبع (الاتزان الديناميكي) عندما يصبح مـعـدل ذوبان المادة الصلبة يساوي مـعـدل ترسيب المادة الذائبـة (عدد الوحدات التي تذوب في المحلول تساوي عدد الوحدات التي تترسب).
(سرعة الترسيب = سرعة الذوبان)
(2) محلول غير مشبع (Unsturated Solution)
هو الذي يحتوي على كمية من الـمـذاب أقل من الكمية اللازمة للتشبع.
(3) محلول فوق مشبع (Super Sturated Solution)
هو الذي يحتوي على كـمـيـة مـن الـمـذاب أكبر من الكمية اللازمة لتشبع المحلول.
سؤال: كيف نحصل على المحلول فوق المشبع .
جواب : نسخـن مـحـلـول مـشبـع يـحـتـوي على مادة صلبة قليلة مـتـرسـبـة حـتى تنوب المادة الصلبة، ثم يرشح المحلول الساخن حـتى تنفصل المواد العـالـقـة به ، ثم يتـرك لـيـبـرد ببطء شدید دون تحريك ، وبذلك فقد لا تترسب المادة الصلبة بانخفاض درجة الحرارة ، وبذلك نحصل على محلول فوق المشبع وللمعلومية فإن المحلول فوق المشبع غير ثابت لأنه إذا رج المحلول أو اضيف إليه بلورة صلبة من المادة المذابة فإن المادة الصلبة تترسب وبذلك نحصل على محلول مشبع فقط .
رابعاً/ أنواع المحاليل حسب التوصيل للتيار الكهربي
يمكن تقسيم المحاليل حسب توصيلها للتيار الكهربي إلى:
(1) الإلكتروليتات (محاليل موصلة للتيار الكهربي) Electrolytes
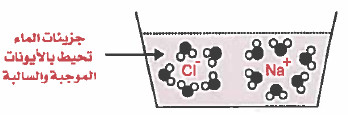
- هي المواد التي تتفكك او تتأين كليا أو جزئيا إلى أيونات عند إذابتها في الماء.
- ومن الأمثلة على الإلكتروليتات: الحموض والقواعد القوية وبعض الأملاح.
- وتنقسم الإلكتروليتات إلى:
- الإلكتروليتات القوية ( محاليل جيدة التوصيل التيار الكهربي)
- الإلكتروليتات الضعيفة (محاليل ضعيفة التوصيل للتيار الكهربي)
(أ) الإلكتروليتات القوية (محاليل جيدة التوصيل للتيار الكهربي)
- هي المواد التي تتفكك أو تتأين كليا إلى أيونات عند إذابتها في الماء.
- الإلكتروليتات القوية كثيرة وتشمل الحموض والقواعد والقوية وبعض الأملاح
- ومن الأمثلة على ذلك كما يلي:
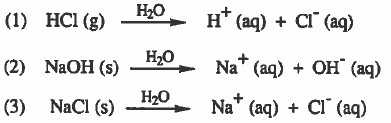
aq = اختصار لـ aqueous وتعني مائي أي أن الايونات محاطة بجزيئات الماء
(ب) الإلكتروليتات الضعيفة (محاليل ضعيفة التوصيل للتيار الكهربي)
- هي المواد التي تتفكك او تتاين جزئيا إلى أيونات عند إذابتها في الماء.
- ومن الأمثلة على الإلكتروليتات الضعيفة الحموض والقواعد الضعيفة وبعض الأملاح:
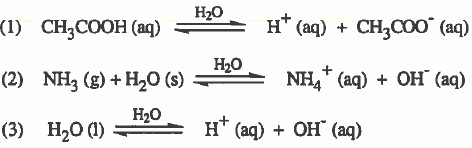
(2) اللا إلكتروليتات (محاليل غير موصلة للتيار الكهربي) Nonelectrolytes
- هي المواد التي لا تتفكك أو تتأين إلى أيونات عند إذابتها في الماء . حيث يبقى المذاب في حالته الجزيئية في الماء
- مثل سكر الجلوكوز و اليوريا وغيره:
