المحاليل المنظمة Buffer Solution
تعريف المحلول المنظم
هو المحلول الذي يقاوم حصول تغيرات كبيرة تركيز أيونات الهيدرونيـوم عند إضافة حمض قوي أو قاعدة قوية إليها.
مم يتكون المحلول المنظم
- يتكون المحلول المنظم من مقدار كبير (تركيز كبير) من حمض ضعيف وملحه أو قاعدة ضعيفة وملحها
- وهذا المزيج يقاوم حدوث تغيرات كبيرة في قيمة الـ pH
علل: المحلول المنظم يقاوم حدوث تغيرات في قيمة pH عند إضافة كمية قليلة من الحمض القوي أو القاعدة القوية.
وذلك لأن المحلول المنظم يحـتـوي على فائض من البروتونات الموجـبـة على شكل حمض ضعيف وفائض من القاعدة على شكل أنيونات سالبة وبذلك يستطيع ان يلغي أثر أي حمض او قاعدة تتم إضافته.
كيفية عمل محلول منظم مكون حمض ضعيف وملحه
- سوف نأخذ كمثال على الحمض الضعيف وملحه مزيج من محلولي حمض الخل وخـلات الصوديوم ( -CH3COOH / CH3COO) والذي يكونـان محلولاً منظمـاً وهذا المحلول يقاوم التغير في قيمة pH ويمكن توضيح ذلك كما يلي:
(أ) عند إضافة كمية قليلة حمض قوي ( أي أيونات +H3O) فإن أيونات الخلات (من المحلول المنظم) تتفاعل مع ايونات الهيدرونيوم (المضافة) لتزيل أثرها وتبقى قيمة pH ثابتة تقريباً.
CH3COO- + H3O+ ↔ CH3COOH + H2O
(ب) عند إضـافـة كـمـيـة قليلة قاعدة قوية (أي أيونات -OH) فإن حمض الخليك (من المحلول المنظم) يتفاعل مع أيونات الهيدروكسيد (المضافة) لتزيل أثرها وتبقى قيمة pH ثابتة.
CH3COOH + OH- ↔ CH3COO- + H2O
سؤال: كيف يستطيع المحلول المنظم المكون من ( الامـونيـا NH3 وكلوريد الامـونـيـوم NH4Cl) أن يقاوم أثر إضافة حمض أو قاعدة إليه.
جواب:
هذا المحلول يقاوم التغيرات الناتجة عن إضافة حمض أو قاعدة اليها كما يلي :
- إذا أضيف حمض إلى المحلول المنظم (+NH3 / NH4) فإن النشادر NH3 يتفاعل مع الحمض (+H3O) وتستهلكه:
NH3 + H3O+ ↔ NH4+ + H2O
- إذا أضيفت قاعدة إلى المحلول المنظم (+NH3 / NH4) فإن أيون الأمونيوم الموجب +NH4 يتفاعل مع القاعدة (-OH) ويستهلكها :
NH4+ + OH- ↔ NH3 + H2O
المحاليل المنظمة في جسم الأنسان
- من المحاليل المنظمـة الموجـودة في الدم محلول مكون من حمض الكربونيك وملح البيكربونات (-H2CO3 / HCO3).
- أما في خلايا الجسم فتوجد ( Na2HPO4 / NaH2PO4 )
قوانين المحاليل المنظمة
ويمكن استخدام القوانين التالية وهي أبسط في التعامل معها:


حيث:
pH = الأس الهيدروجيني
pOH = الأس الهيدروكسيلي
Ka = ثابت تفكك الحمض الضعيف حيث ( pKa = - log Ka)
Kb = ثابت تفكك القاعدة الضعيفة حيث ( pKb = - log Kb)
[asid] = تركيز الحمض الضعيف
[base] = تركيز القاعدة الضعيفة
[salt] = تركيز الملح
[+H3O] = تركيز أيونات الهيدرونيوم
[-OH] = تركيز أيونات الهيدروكسيد
ملاحظات هامة
(أ) عندما يكون لدينا محلول لحمض ضعيف مثل CH3COOH فإن قيمة (+H3O) لها قيمة معينة ، وعند إضافة ملح قاعدي مثل (CH3COONa) فإن قيمة (+H3O) سوف تقل
وبالتالي تزداد قيمة pH ، وقيمة pOH تقل ، وقيمة (-OH) تزداد .
(ب) عندما يكون لدينا محلول لقاعدة ضعيفة مثل NH3 فإن قيمة (-OH) لها قيمة معينة، وعند إضافة ملح حمضي مثل (NH4C1) فإن قيمة ( -OH ) سوف تقل .
وبالتالي تزداد قيمة POH ، وقيمة pH تقل ، وقيمة (+H3O) تزداد .
اشتقاق قانون هندرسون – هاسلبالخ للمحاليل المنظمة
- يمكن اشتقاق قانون هندرسون – هاسلبالخ ( pH = pKa + log salt/acid ) كما يلي:
إذا افترضنا وجود محلول منظم مكون من حمض الخل وملحه:
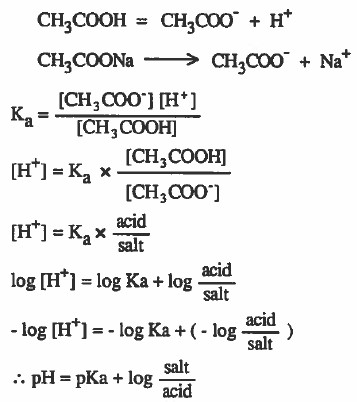
ويمكن اشتقاق قانون هندرسون - هاسلبالخ ( pOH = pKb + log salt/acid ) كما سبق.
أمثلة على المحاليل المنظمة
(أ) حمض ضعيف وملحه: (في هذه الحالة 7 > pH)
- حمض الخل + خلات الصوديوم (CH3COOH + CH3COONa)
- حمض الهيدروسيانيك + سيانيد الصوديوم (HCN + NaCN)
- حمض البنزويك + بنزوات الصوديوم (C6H5COONa + C6H5COOH)
- حمض النيتروز + نيتريت الصوديوم (NaNO2 + HNO2)
- حمض الفورميك + فورمات الصوديوم (HCOONa + HCOOH)
- حمض الفلور + فلوريد الصوديوم (NaF + HF)
(ب) قاعدة ضعيفة وملحها: (في هذه الحالة 7 < pH)
- النشادر + كلوريد الأمونيوم ( NH3 + NH4C1 )
- ميثيل امين وملحه +CH3NH2 , CH3NH3
- هيدرازين وملحه +N2H4, N2H5