تعيين ثابت السرعة بطريقة توليد الغاز
نظرية التجربة
- يتحلل كلوريد ديازونيوم البنزين عند تسخينه مع الماء حسب التفاعل التالي:
C6n5N2Cl + H2O→ C6H5OH + HCl + N2
- يمكن تتبع مسلك التفاعل بقياس حجم النتروجين المتولدز
- بوجود كمية فائضة من الماء يتبع التفاعل حركة الدرجة الأولى فاذا كان التركيز البدائي لكلوريد ديازونيوم البنزين a وبعد زمن t أصبح تركيزه (a-x)
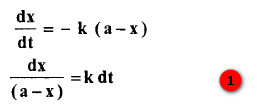
- بتكامل المعادلة (1) وبتطبيق الظروف عندما تكون x = 0 عندما t = 0 ينتج لدينا :
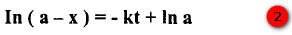
- فإذا كان حجم النتروجين الكلي المتولد من التفاعل ∞v وكان حجم النيتروجين المتولد حتى الزمن t هو vt ، عندها تتناسب a مع ∞v ، ويتناسب x مع vt
- بالتعويض بالمعادلة (2) يمكنا كتابة ما يلي :
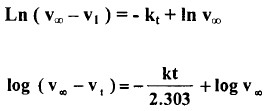
- ويعطي رسم (v∞ -vt) log مقابل t خطاً مستقيماً ميله k / 2.303 - .
الأدوات والكيماويات اللازمة للتجربة
- أنبوبة ترشيح Hirseb
- سحاحة
- غاز
- خلاط متصل بحوض زئبقي محكم بحيث لا يتسرب منه زئبق
- ساعة توقيت
- أنيلين
- حمض هيدروكلوريك مركز
- نترات الصوديوم
خطوات العمل
- يتم تحضير محلول كلوريد ديازونيوم البنزين كما يلي:
- يذاب 7 جم أنيلين في 22 مل من حمض الهيدروكلوريك المركز ويبرد المحلول الناتج بماء ثلج يضاف تدريجياً وبشكل قطرات من قمع ذي صمام محلول بارد مكون من 5 جم نترات الصوديوم في 75 مليليترا ماء. يتمم المحلول إلى لتر.
- يوضع حوالي 30 مل من المحلول بالمفاعل.
- يثبت عليه الخلاط ثم يعلق المفاعل بثرموستات عند درجة الحرارة 35 مo.
- يترك الجهاز عند هذه المرحلة مفتوحاً للجو بواسطة الصمام T المبين بالشكل التالي:
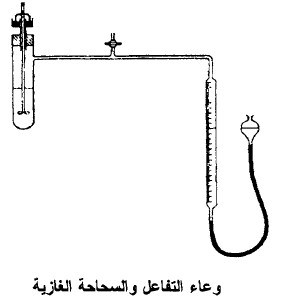
- يشغل الخلاط ويترك المحلول 5 إلى 7 دقائق ليصل إلى درجة حرارة الثرموستات نفسه.
- بعدها يغلق الصمام ويلاحظ الزمن، ويعتبر هذا الزمن كبدء للتفاعل.
- يقرأ حجم الغاز المتولد بفترات زمنية مقدارها 15 دقيقة.
- يجب ضبط خزان السحاحة الغازية باستمرار بحيث لا يبتعد الضغط كثيرًا عن الضغط الجوي.
- تلاحظ درجة حرارة الغاز والضغط البارومتري مع وجوب تصحيح أي تغيرات طارئة.
- تحدد ∞v بغمس المفاعل في حوض من الماء الساخن، ثم تبريده إلى درجة حرارة التجربة عندها يلاحظ حجم الغاز المتولد.
- يجب إعادة هذه التجربة إلى أن لا يحدث هناك زيادة بحجم الغاز المراقب. ويكون عندها الحجم النهائي مناظراً ∞v
- يرسم شكل بياني من (v∞ -vt) log مقابل t وتحدد قيمة ثابت السرعة عند درجة حرارة التجربة.