الترتيب الإلكتروني Electron Configuration
- يتجه التغيّر في معظم الظواهر الطبيعية نحو أقلّ طاقة ممكنة، فالأنظمة ذات الطاقة المرتفعة غير مستقرة ، ولذلك فهي تفقد طاقة لتصبح أكثر استقرارًا.
- وفي الذرّة تتفاعل الإلكترونات والنواة يؤثر كلّ منهما على الآخر للوصول إلى أقصى ترتيب مستقر .
- تسمّى الطرق التي تترتب بها الإلكترونات حول أنوية الذرّات بالترتيبات الإلكترونية Electron Configurations
القواعد الثلاث التي تنظّم ملء الأفلاك الذرّية بالإلكترونات
- لإيجاد الترتيبات الإلكترونية للذرّات، هناك ثلاث قواعد يجب اتباعها وهي مبدأ أوفباو ، ومبدأ باولي للاستبعاد ، وقاعدة هوند.
(1) مبدأ أوفباو (مبدأ البناء التصاعدي) Aufbau's Principle
- يتبع الترتيب الإلكتروني مبدأ أوفباو . وطبقاً لهذه القاعدة، تدخل الإلكترونات في تحت مستويات الطاقة ذات الطاقة المنخفضة أولًا، ثم تملأ الأعلى منها بعد ذلك .
- ينص هذا المبدأ على أنه: (لا بد للإلكترونات أن تملأ تحت مستويات الطاقة ذات الطاقة المنخفضة أوّلًا ، ثم تحت مستويات الطاقة ذات الطاقة الأعلى) .
- يوضّح الشكل التالي طريقة ملء تحت مستويات الطاقة.

- يسكن الإلكترون الأفلاك الأقل طاقة أوّلًا مع الأخذ في الاعتبار أنّ الأفلاك المتعددة (2pz ، 2py ، 2px) لتحت مستوى الطاقة (2p) لمستوى الطاقة الرئيسي (2 = n) متساوية دائمًا في الطاقة (تم ذكر أفلاك تحت المستوى (2p) ، على سبيل المثال. وتنطبق القاعدة على جميع الأفلاك المختلفة لتحت مستويات الطاقة التابعة لمستوى طاقة رئيسي معين ما عدا أفلاك تحت مستويات الطاقة f و d) .
- فضلاً عن ذلك، فإن تحت مستوى الطاقة s هو دائمًا الأقل طاقة بين تحت مستويات الطاقة داخل مستوى الطاقة الرئيسي .
- يلاحظ أيضًا أن سلسلة من تحت مستويات طاقة داخل مستوى طاقة رئيسي يمكن أن تتخطى تحت مستويات طاقة لمستوى رئيسي مجاور.
- لاحظ أن ملء الأفلاك الذرية لا يسلك نموذجا بسيطاً بعد مستوى الطاقة الثاني. على سبيل المثال ، إنّ فلك 4s أقل طاقة من أفلاك تحت المستوى 3d ، وهذا موضح من خلال مخطط أوفباو أدناه حيث يمثل كلّ مربع ( ) فلكاً ذرّيًا.
) فلكاً ذرّيًا.

(2) مبدأ باولي للاستبعاد Pauli's Exclusion Principle
- وضع باولي عام 1925 مبدأ مهماً يحكم ترتيب الإلكترونات حول أنوية الذرّة.
- وينص على أنه: (في ذرة ما ، لا يوجد إلكترونان لهما أعداد الكم الأربعة نفسها، إذ لا بد أن يختلفا في عدد كم واحد على الأقل).
- فإلكترونا الفلك 2s مثلاً، لهما قيم n , ml , l نفسها ، ولكنهما يختلفان في عدد الكم ms حيث يغزل أحدهما بعكس اتجاه الآخر.
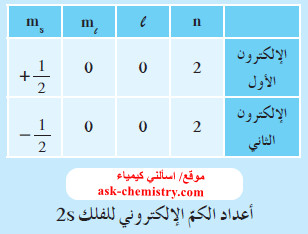
- يتسع كل فلك لإلكترونين، ويجب أن يكون دورانهما المغزلي في اتجاهين متضادين . لذا فإنّ كلّ إلكترونين موجودين في فلك واحد يكونان مختلفين في لفهما المغزلي ويكونان متزاوجين.
- يمثل اللفت المغزلي للإلكترون في أحد الاتجاهين بسهم رأسي متجه لأعلى ↑ ، والإلكترون ذو الدوران المغزلي بالاتجاه المعاكس بسهم متجه لأسفل ↓ ويكتب الفلك الذي يحتوي على إلكترونات متزاوجة كالتالي ↑↓
(3) قاعدة هوند Hund's Rule
- اقترح العالم هوند عام 1927 ، في ضوء نتائج تجريبية توصل إليها (أن الإلكترونات تملأ أفلاك تحت مستوى الطاقة الواحد ، كل إلكترون بمفرده باتجاه الغزل نفسه ، ثم تبدأ بالازدواج في الأفلاك تباعًا باتجاه غزل معاكس).
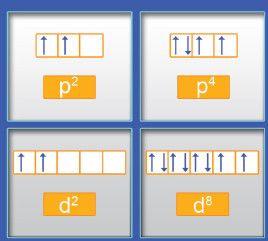
- عندما تشغل الإلكترونات أفلاكا متساوية في الطاقة (2pz ، 2py ، 2px) تتوزع أولاً بحيث يدخل إلكترون واحد في كل فلك إلى أن تمتلئ جميع الأفلاك بإلكترون واحد . ويكون الدوران المغزلي لهذه الإلكترونات في الاتجاه نفسه.
- على سبيل المثال، إذا وجدت ثلاثة إلكترونات تشغل أفلاكًا متساوية الطاقة، يكون ترتيبها كالتالي  ولا يكون
ولا يكون  .
.
- تضاف الإلكترونات التالية بعد ذلك لكل فلك بحيث يزدوج دورانها المغزلي مع الإلكترونات الأولى . وبالتالي ، يستطيع كل فلك أن يحتوي على إلكترونين مزدوجي الغزل.
- نظرًا إلى الترتيبات الإلكترونية لذرات 9 عناصر في الجدول التالي :
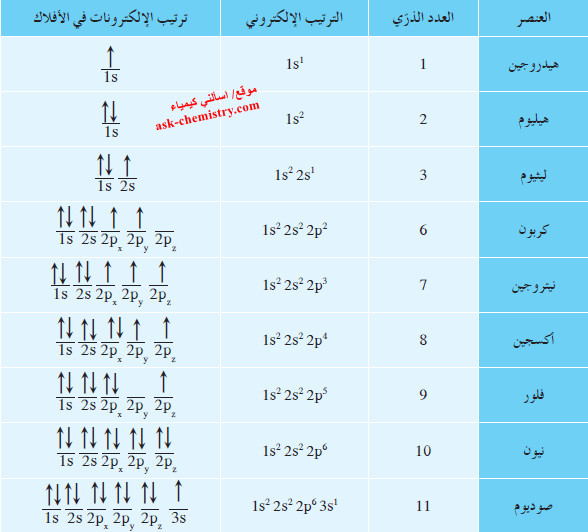
- تجد أنّ ذرّة الأكسجين تحتوي على 8 إلكترونات حيث يأخذ الفلك الأقل طاقة 1s إلكترونين دورانهما المغزلي باتجاهين متضادين (مزدوجين). الفلك التالي (الأدنى طاقة) الذي يجب ملؤه هو 2s، ويأخذ أيضًا إلكترونين متضادي الغزل . ثمّ يدخل كلّ من الإلكترون الخامس والسادس والسابع الأفلاك الثلاثة المتساوية الطاقة لتحت مستوى الطاقة 2p ، بحيث يحتوي كلّ فلك على إلكترون واحد ويكون الدوران المغزلي لهذه الإلكترونات في الاتجاه نفسه.
- يدخل الإلكترون الثامن في أحد الأفلاك الثلاثة لتحت مستوى الطاقة 2p حيث يزدوج مع الإلكترون الموجود فيه، ويبقى الفلكان الآخران لتحت مستوى الطاقة 2p نصف ممتلئين بإلكترون واحد في كلّ منهما.
- لذلك لا يمكن للفلك الواحد أن يستوعب أكثر من إلكترونين فمثلاً،
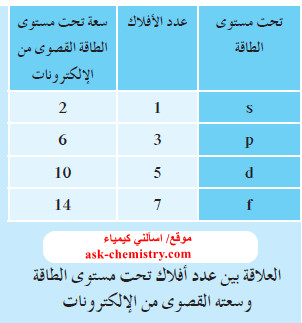
- يحتوي تحت مستوى الطاقة s على فلك واحد ، فتكون سعته القصوى إلكترونين.
- يحتوي تحت مستوى الطاقة p على ثلاثة أفلاك ، فتكون سعته القصوى 6 إلكترونات.
- يحتوي تحت مستوى الطاقة d على خمسة أفلاك ، فتكون سعته القصوى 10 إلكترونات.
- يحتوي تحت مستوى الطاقة f على سبعة أفلاك، فتكون سعته القصوى 14 إلكتروناً.
طريقة مختصرة لكتابة الترتيب الإلكتروني
- هناك طريقة مختصرة ملائمة لتوضيح الترتيب الإلكتروني للذرة.
- تتضمن هذه الطريقة كتابة رقم مستوى الطاقة ورمز كلّ تحت مستوى الطاقة التي يشغلها إلكترون ما .
- ثمّ يُكتب عدد الإلكترونات أعلى يمين رمز تحت مستوى الطاقة.
- فيمكن كتابة الترتيب الإلكتروني لذرّة الهيدروجين التي تحتوي على إلكترون واحد في فلك 1s كالتالي: 1s1 ، وللهيليوم الذي يحتوي على إلكترونين في الفلك 1s على النحو التالي 1s2.
- كما يمكن كتابة الترتيب الإلكتروني لذرّة الأكسجين التي تحتوي على إلكترونين في فلك 1s، وإلكترونين في فلك 2s ، وأربعة إلكترونات في أفلاك 2p كالتالي: 1s2 2s2 2p4.
- لاحظ أن مجموع الأعداد العلوية يساوي عدد الإلكترونات في الذرة.