التدرج في الميل الإلكتروني
- الميل الإلكتروني هو كمّيّة الطاقة المنطلقة عند إضافة إلكترون إلى ذرّة غازية متعادلة لتكوين أيون سالب في الحالة الغازية.
- يمكن التعبير عن الميل الإلكتروني بالمعادلة التالية:

- انطلاق الطاقة عند إضافة الإلكترون إلى الذرّة يشير إلى حالة أدنى من الطاقة ، أي إلى حالة أكثر استقرارًا.
- يفسّر ذلك ميل بعض الذرّات إلى اكتساب الإلكترونات للوصول إلى حالة طاقة أدنى وثبات أكبر خلال التفاعلات الكيميائية.
- الميل الإلكتروني من الخواص التي تتغير في الجدول الدوري.
- معظم العناصر لها ميل إلكتروني سالب.
- على الرغم من أن الميل الإلكتروني يتغيّر بطريقة عشوائية خلال الجدول الدوري، إلا أنّه يمكن ملاحظة بعض الاتجاهات لهذا الميل.
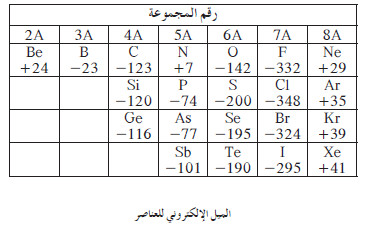
تدرج الميل الإلكتروني فى المجموعات
- يتناقص الميل الإلكتروني من أعلى إلى أسفل، أي كلما تزايد العدد الذري، يعود ذلك إلى:
- زيادة عدد المستويات الأصلية
- زيادة عدد المستويات المستقرة
- زيادة عدد الإلكترونات المتنافر
- من الملاحظ أن الميل الإلكتروني لذرّة الفلور أقل من الميل الإلكتروني لذرّة الكلور على الرغم من صغر نصف قطر الفلور، وذلك بسبب تأثر الإلكترون المُضاف بقوّة تنافر مع الإلكترونات التسعة الموجودة أصلاً.
تدرج الميل الإلكتروني فى المجموعات
- يتزايد الميل الإلكتروني من اليسار إلى اليمين في الدورة الواحدة، أي كلّما تزايد العدد الذرّي.
- يعود السبب إلى أن الحجم الذرّي يقل، ممّا يسهل على النواة جذب الإلكترون المُضاف (الجديد).
- يشذ الميل الإلكتروني لكل من العناصر Be4 ، N7 ، Ne10 عن التدرّج في عناصر الدورة الثانية.