الترتيبات الإلكترونية النقطية
- تعتبر إلكترونات التكافؤ الإلكترونات الوحيدة التي تستخدم عادة في تكوين الروابط الكيميائية، ولذلك فهي كقاعدة عامة، الإلكترونات الوحيدة التي تظهر في الترتيبات الإلكترونية النقطية.
- الترتيبات الإلكترونية النقطية Electron Dot Structures هي الأشكال التي توضح إلكترونات التكافؤ في صورة نقاط.
- يوضح الجدول التالي الترتيبات الإلكترونية النقطية لذرّات بعض عناصر المجموعات A.
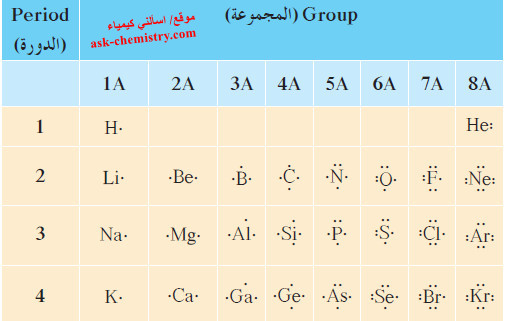
- لاحظ في الجدول أن جميع عناصر المجموعة الواحدة (باستثناء الهيليوم) لها عدد النقاط الإلكترونية نفسه في الترتيب الخاص بكل عنصر.
ترتيبات لويس الإلكترونية النقطية
- تعلمت سابقا أنّ إلكترونات التكافؤ لذرّة ما تدخل في تكوين الروابط الكيميائية ونظرًا لأهمية هذه الإلكترونات ، فإنه من المهم أن تكون قادرًا على دراسة إلكترونات التكافؤ الخاصة بالذرّات والمركبات .
- يستخدم الكيميائيون تسمية خاصة تُميّز الإلكترونات بالنقاط، والروابط الناتجة منها بالخطوط . تُعرف هذه التسمية بترتيب لويس الإلكتروني النقطي نسبة للعالم الأميريكي جيلبرت لويس.
- تساعد كتابة الترتيبات الإلكترونية على فهم كيفية ترتيب الإلكترونات في الجزيئات وإعادة ترتيبها أثناء التفاعلات الكيميائية وكيفية مساهمة الإلكترونات في تحديد شكل جزيء ما.
- الترتيبات الإلكترونية النقطية للذرات في الترتيب الإلكتروني النقطي ، يمثل رمز العنصر نواة الذرّة وإلكتروناتها الداخلية معا، فيما تمثل النقاط التي توضع حول رمز العنصر إلكترونات التكافؤ.
- لكتابة الترتيب الإلكتروني النقطي لذرّة ما ، عليك الاستعانة بالجدول الدوري لمعرفة عدد إلكترونات التكافؤ.
- على سبيل المثال، لليود سبعة إلكترونات تكافؤ.
- اكتب رمز الذرّة ثم ضع النقاط حول الرمز ولا تكتب أكثر من نقطتين على كل جانب من جانبي الرمز الكيميائي . بذلك، يكون الترتيب الإلكتروني النقطي لليود هو:
