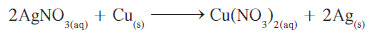خطوات وزن المعادلة الكيميائية
- الخطوة الأولى: حدّد الصيغ الصحيحة للمتفاعلات والنواتج ، مع كتابة حالتها الفيزيائية في أقواس بعد كل صيغة .
- الخطوة الثانية: اكتب صيغ المواد المتفاعلة على اليسار، وصيغ المواد الناتجة على اليمين وضع بينهما سهما، وإذا كان هناك أكثر من متفاعل واحد، وأكثر من ناتج واحد ضع بينهما علامة (+). وإذا استخدم عامل حفاز ، أكتب صيغته الكيميائية فوق السهم، وإذا استخدمت الحرارة ، أكتب رمزها (Δ) أيضًا فوق السهم. وبذلك تكون قد أتممت كتابة المعادلة الكيميائية.
- الخطوة الثالثة: احسب عدد الذرّات لكلّ عنصر في طرفي المعادلة أي للمتفاعلات والنواتج . (وفي حال وجود أيون عديد الذرات غير متغير على طرفي المعادلة ، يُحسب هذا كوحدة واحدة.)
- الخطوة الرابعة: زن المعادلة بضبط المعاملات أمام الصيغ حتى تحصل على أعداد متساوية بين ذرات كل عنصر من المواد المتفاعلة والمواد الناتجة من التفاعل . واعرف ضمنا أن عدم وجود معامل أمام الصيغة ، يعني أن المعامل يُساوي الواحد الصحيح، والأفضل أن تبدأ عملية الوزن بالعناصر التي تظهر مرة واحدة فقط في طرفي المعادلة. ويُلاحظ في عملية الوزن أنه لا يُمكن تغيير أي رقم مكتوب أسفل الرموز لأن ذلك يُغير من نوعية المواد.
- الخطوة الخامسة: تأكد من تساوي عدد كل ذرة أو أيون عديد الذرات في كل من طرفي المعادلة لتتأكد من وزن المعادلة تحقيقاً لقانون بقاء الكتلة .
- الخطوة السادسة: تأكد أخيراً من أنك استخدمت المعاملات في أقل نسبة عددية صحيحة لموازنة المعادلة.
أمثلة على وزن المعادلة الكيميائية
مثال (1): تتفاعل كربونات الصوديوم الهيدروجينية (بيكربونات صوديوم) مع حمض الهيدروكلوريك لتكون محلولاً مائياً من كلوريد الصوديوم والماء وغاز ثاني أكسيد الكربون . اكتب المعادلة الهيكلية لكل من المتفاعلات الكيميائية والنواتج مستخدما الرموز.
الحل
- اكتب الصيغة الصحيحة لكل مادة في التفاعل. افصل المتفاعلات عن النواتج، ووضح الحالة الفيزيائية لكل مادة .
- اكتب الصيغ الكيميائية والحالة الفيزيائية للمتفاعلات:
- كربونات صوديوم هيدروجينية (بيكربونات صوديوم) الصلبة NaHCO3(s)
- محلول مائي من حمض الهيدروكلوريك HCl(aq)
- اكتب الصيغ الكيميائية والحالة الفيزيائية للنواتج:
- محلول مائي من كلوريد الصوديوم NaCl(aq)
- الماء H2O(l)
- غاز ثاني أكسيد الكربون CO2(g)
- اكتب المعادلة الكيميائية الهيكلية للتفاعل:
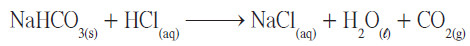
مثال (2): يتفاعل الألمنيوم مع الأكسجين في الهواء ليكون طبقة رقيقة من أكسيد الألمنيوم تغطي الألمنيوم وتحميه من الأكسدة . زن معادلة هذا التفاعل:
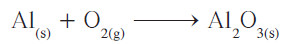
الحل
- طبق قواعد وزن المعادلات الكيميائية .
- زن أولاً عدد ذرات الألمنيوم في كل من طرفي المعادلة بوضع المعامل 2 أمام Al.
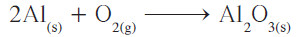
تظهر هنا مشكلة تتكرر كثيرًا في وزن المعادلات الكيميائية، ويُمكن تسميتها مشكلة الأعداد الزوجية والفردية، لأن أي معامل يوضع أمام O2 سوف يُعطي أعدادًا زوجية من ذرّات الأكسجين في الطرف الأيسر ، لأن هذا المعامل سوف يضرب باستمرار في رقم 2 (عدد ذرات الأكسجين في جزيء غاز الأكسجين).
- كيف يمكننا تحويل الرقم الفردي لذرات الأكسجين الموجود في الطرف الأيمن للمعادلة، إلى رقم زوجي لكي يتزن مع الرقم الزوجي لعدد ذرات الأكسجين في الطرف الأيسر؟ أسهل طريقة للوصول إلى ذلك هي وضع معامل زوجي 2 أمام صيغة Al2O3 لتحويل عدد ذرات الأكسجين الفردية إلى زوجية:
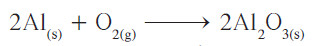
- أصبح عدد ذرات الأكسجين في الطرف الأيمن من المعادلة يُساوي 6 ذرّات، بينما في الطرف الأيسر ذرتين فقط، فيلزم وضع معامل 3 أمام O2 ، وكذلك تصحيح معامل الألمنيوم ليُصبح 4 بدلاً من 2.
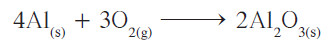
توضيح
هناك أعداد متساوية من ذرات العناصر المتفاعلة والناتجة ، كذلك المعاملات في أبسط نسبة عددية صحيحة . ولنفترض أننا كتبنا معادلة تكوين أكسيد الألمنيوم كما يلي:
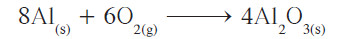
تبدو هذه المعادلة صحيحة لأنها تتبع قانون بقاء الكتلة، وعلى الرغم من ذلك، ولكون المعاملات ليست في أبسط نسبة عددية صحيحة فيمكن قسمة جميع المعاملات على 2 لنحصل على المعادلة التي حصلنا عليها من قبل، والتي تظهر فيها المعاملات في أصغر نسبة عددية صحيحة.
مثال (3): يتفاعل الهيدروجين والأكسجين لتكوين الماء. اكتب معادلة كيميائية رمزية موزونة لهذا التفاعل.
الحل
- طبق قواعد وزن المعادلات للمعادلة الكتابية التي تصف التفاعل.
- اكتب الصيغة الصحيحة للمتفاعلات والنواتج لتحصل على المعادلة الهيكلية:
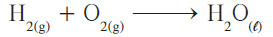
- إذا قمت بعد أعداد ذرات الهيدروجين، تجد أنّها موزونة في طرفي المعادلة في حين أن أعداد ذرات الأكسجين غير موزونة ، وإذا قمت بوضع معامل 2 أمام H2O فإنه يُؤدي إلى تساوي ذرات الأكسجين في طرفي المعادلة:
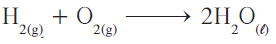
- ولكنك الآن تجد أن عدد ذرات الهيدروجين في الطرف الأيمن ضعف عددها في الطرف الأيسر، ولهذا يجب وضع معامل 2 أمام H2 بهذا تُصبح المعادلة موزونة.
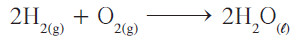
مثال (4): عند عمر سلك من فلز النحاس في محلول مائي من نيترات الفضة، تترسب بلورات الفضة على سلك النحاس . زن معادلة هذا التفاعل

الحل
- طبق قواعد وزن المعادلات الكيميائية، حيث إن أنيون النيترات، وهو أنيون عديد الذرات يتواجد في المتفاعلات والنواتج ، فيُمكن وزنه كوحدة واحدة.
- ضع معامل 2 أمام AgNO3 لوزن أنيون النيترات:

- بالنظر إلى هذه المعادلة، نُلاحظ أنّ الفضّة غير موزونة في الطرفين، ولذا يوضع معامل 2 أمام Ag