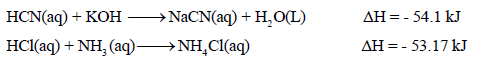حرارة التعادل Heat of Neutralization
- حرارة التعادل ھي كمیة الحرارة الناتجة من تكوین مول واحد من الماء من تعادل حمض مع قاعدة.
- أو ھي كمیة التغیر في المحتوى الحراري عندما يتعادل واحد جرام مكافئ من الحمض مع واحد جرام مكافئ من القاعدة في المحالیل المخففة.
- والمقصود بالمحالیل المخففة ھي تلك المحالیل التي تحتوي على كمیة كبیرة من الماء، حیث تكون المواد المتفاعلة والناتجة من التفاعل ثابتة التفكك، ومحصلة التفاعل ھي ببساطة عملیة تكوین الماء غیر المتفكك.
أولاً: قیم حرارة التعادل للأحماض والقواعد القویة
- ومن الثابت أن قیم حرارة التعادل للأحماض والقواعد القویة واحدة وثابتة بغض النظر عن نوع الحمض القوي أو القاعدة القوية المستخدمة في عملية التعادل
- قيمة حرارة التعادل للأحماض والقواعد القوية تساوي (57.5KJ-) وسبب ثباتها تقريباً لأن حرارة التعادل في الأصل ھي حرارة تكوین مول واحد من الماء ، حيث أن التفاعل الحقيقى بين حمض وقاعدة قويين في عملية التعادل هو اتحاد أيونات الهيدروجين (H+) وأيونات الهيدروكسيد (OH-) لتكوين الماء.
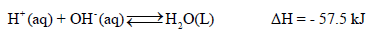
أمثلة :
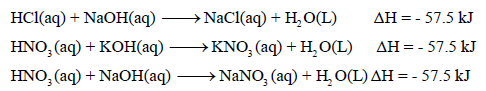
ثانياً: قيم حرارة تعادل الأحماض والقواعد الضعیفة
في حالة تعادل الأحماض والقواعد الضعیفة (غير تامة التفكك) فإن حرارة التعادل الناتجة سوف تختلف عن المقدار (57.5kj-) لأن التفاعل سوف يشتمل على عملية تفكك الحمض الضعيف والقاعدة الضعيفة (تفاعل ماص للحرارة) ، وعملية تكوين الماء من أيونات (H+) و (OH-) (تفاعل طارد للحرارة) ، وتكون حرارة التعادل في ھذه الحالة ھي محصلة العملیتین السابقتین.
- وبالتالي فإن حرارة التعادل في حالة الأحماض والقواعد الضعیفة سوف تتوقف على نوع الحمض أو القاعدة الضعیفة.
-أمثلة: