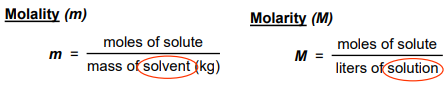
(1) المولارية Molarity
- هي عدد مولات المادة المذابة في لتر من المحلول.
- نستخدم العلاقة :

- ويمكن حساب عدد مولات المذاب بالقانون التالي:
عدد المولات = وزن المادة المذابة بالجرام/الوزن الجزيئي للمادة المذابة .
- وحدة قياس المولارية هي مولر Molar أو مول/لتر mol/L
- مثال محلول : احسب مولارية محلول مكون من 2mol من كلوريد الكالسيوم مذاب في كمية من الماء بحيث اصبح حجم المحلول 2L
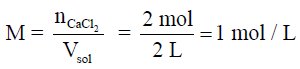
(2) المولالية Molality
- هي عدد مولات المادة المذابة في كيلو جرام من المذيب .
- نستخدم من العلاقة:

- وحدة قياس المولالية هي مولل Molal أو مول/كجم mol/Kg
- مثال محلول: احسب التركيز بالمولالية لمحلول تم تحضيره بإذابة 2mol من حمض الكلور في 800 جم من الماء.
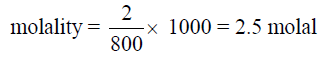
ملاحظة هامة