التكافؤ فى الحديد
- تكافؤ مركبات الحديد غالباً ما يكون +2 أو +3 ويطلق على مركبات الحديد ثنائية التكافؤ (حديدوز) مثل أكسيد الحديدوز (FeO)، وعلى مركبات الحديد ثلاثية التكافؤ (حديديك) مثل أكسيد الحديديك (Fe2O3).
- قد يصبح تكافؤ مركبات الحديد سداسي التكافؤ ، +6 كحالة رابع حديدات البوتاسيوم (K2FeO4).
- كما أن مركبات الحديد التي تشارك في تفاعلات الأكسدة البيوكيميائية، رباعية التكافؤ.
- كما تتواجد مركبات عضوية معدنية للحديد ذات تكافؤ أحادي موجب أو أحادي سالب أو ثنائي سالب. بل ويتواجد الحديد أحياناً في حالته العنصرية داخل جسم الإنسان.
- كما يتواجد مركبات للحديد يكون فيها الحديد ذا تكافؤ ثنائي وثلاثي في الوقت ذاته كأكسيد الحديد الأسود (الماغنتيت) ومركب أزرق بروسيا (Fe4(Fe[CN]6)3) ، والذي يستخدم بعض أنواع أوراق الطباعة التي تستخدم في بعض الرسومات الهندسية.
حالات التأكسد المختلفة للعناصر الانتقالية
- الحديد عنصر انتقالى
- إن العناصر الانتقالية عموماً تكون أيونات بمدى واسع من حالات التأكسد.
- وتظهر حالات التأكسد العديدة للعناصر الانتقالية نظرا لأن حالة الامتلاء الجزئي في المستوى الفرعي d تمكن هذه العناصر من تقبل أو إعطاء الإلكترونات في التفاعلات الكيميائية.
- يمكن للعناصر الانتقالية أن تفقد حتى 9 إلكترونات. ويمكن الوصول لسبب هذا عن طريق دراسة المحتوى الحراري للتأين.
- أي عنصر انتقالي مثل الفانديوم له تقريبا زيادة خطية في المحتوى الحراري للتأين خلال إلكترونات المدارات s، d، نظرا لقرب الطاقة بين المدارات 3d و 4s. وعلى هذا فإن العناصر الانتقالية غالبا ما توجد في حالات عالية.
أعداد تأكسد الحديد
Fe26 : [Ar] 4s2 , 3d6
- حالة التأكسد (+2) للحديد حيث يفقد إلكترون من 4s والكترون من 3d حيث يصبح 3d نصف ممتلي.
- حالة التأكسد (+3) للحديد حيث يفقد إلكترونين من 4s والكترون من 3d حيث يصبح 3d نصف ممتلي.
- أقصى حالة تأكسد لأى عنصر انتقالي = إلكترونى المستوى الفرعي 4s + عدد الألكترونات المفردة في المستوى الفرعي 3d
- أقصى حالة تأكسد فى حالة الحديد = 2 + 4 = 6
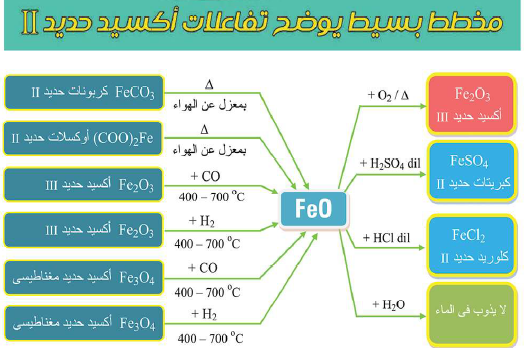
أهم تفاعلات أكسيد الحديد الثنائي
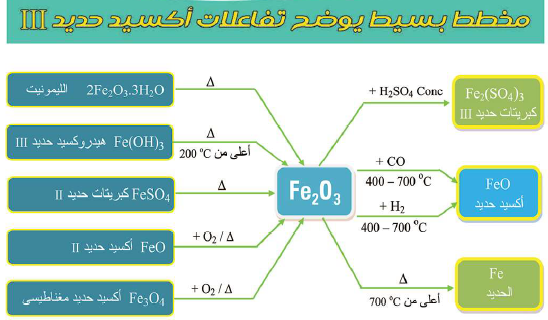
أهم تفاعلات أكسيد الحديد الثلاثي
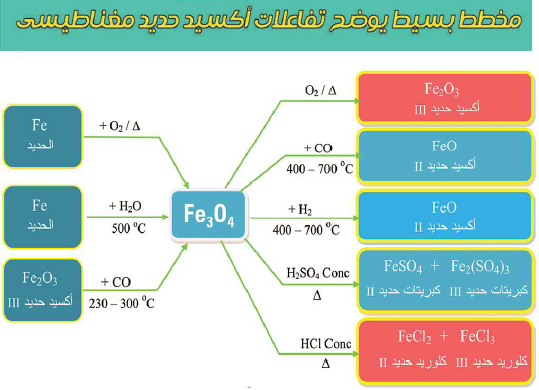
أهم تفاعلات أكسيد الحديد المغناطيسي