تحضير المحاليل المنظمة
الأساس النظري
- المحلول المنظم هو محلول يتميز بمقاومته للتغيرات في الرقم الهيدروجينى الناتجة عن إضافة كميات صغيرة من حمض أو قاعدة ولا يتغير الرقم الهيدروجيني بالتخفيف.
- يتكون المحلول المنظم من خليط من حمض ضعيف وأحد أملاحه أو قاعدة ضعيفة أو قاعدة ضعيفة وأحد أملاحه أو قاعدة ضعيفة وأحد أملاحها
- الجدول التالي يعطي بعض الأمثلة على المحاليل المنظمة:
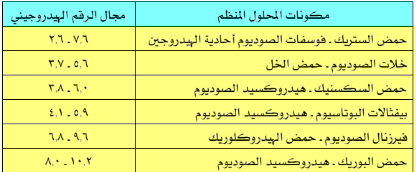
- تستعمل هذة المحاليل مثلاً أثناء تعيير قياس الرقم الهيدروجينى pH-meter أو لتثبيت الرقم الهيدروجيني في معايرات التحليل الحجمي أو فى التحليل الوزني.
- يمكن شراء المحاليل المنظمة ذات رقم هيدروجيني معين أو تحضيرها في المختبر.
طرق تحضير المحاليل المنظمة
لتحضير محلول منظم نتبع الخطوات التالية
(1) اختر المركب المناسب بحيث تكون قيمة pKa قريبة من قيمة pH المرغوب فيه.
(2) حدد التركيز والحجم الذي ترغب به.
- هناك طرق عديدة لتحضير المحاليل المنظمة ومنها:
(1) تحضير المحاليل المنظمة مستخدماً معلومات متوفرة في المراجع.
(2) حساب كمية المواد المكونة للمحلول المنظم وإذابتها في الحجم المناسب من ماء مقطر ثم التأكد من قيم الرقم الهيدروجينى مستخدماً جهاز القياس.
الحسابات
- يحسب pH للمحلول المنظم من معادلات Henderson-Hasselbalch:
أولاً: في حالة تحضير المحلول المنظم من حمض ضعيف وأحد أملاحه نستعمل المعادلة التالية:
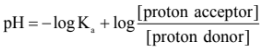
علماً بأن:
Ka : ثابت تفكك الحمض
proton donor : المادة المانحة للبروتون
Proton acceptor : المادة التى يتحد معها البروتون.
- حسب نظرية Lowry , Bronsted الحمض هي المادة المانحة للبروتون والقاعدة هي المادة التى تستقبل هذا البروتون.
Acid → H+ + base
ثانياً: في حالة تحضير المحلول المنظم من قاعدة ضعيفة وأحد أملاحها نستعمل المعادلة التالية:
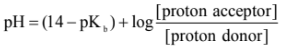
علماً بأن pKb = - log Kb
مثال: احسب pH لمحلول منظم حضر بإضافة 10 مل من حمض الخليك CH3COOH تركيزه 0.1M إلى 20 مل من خلات الصوديوم CH3COONa تركيزه 0.1M وثابت التفكك لحمض الخليك Ka = 1.75 X 10-5
الحل:
أولاً: نحسب تركيز كل من الحمض وملحه بعد مزج هذة المحالل (في الحجم الكلي).
عدد ملمولات حمض الخليك = 0.1 × 10 = 1 مليمول
عدد ملمولات أيون الخلات -CH3COO يساوي = 0.1 × 20 = 2 مليمول
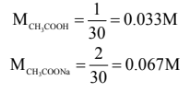
ثانياً: نحسب pH
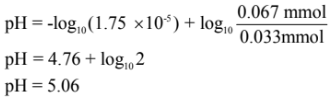
تحضير المحلول المنظم
الأدوات والمواد المستخدمة
- محلول أمونيا 0.1M
- محلول كلوريد الأمونيوم 0.1M
- محلول منظم قياسي pH=12
- ماصة
- ورق pH قياسي
- جهاز قياس الرقم الهيدروجيني.
المطلوب: تحضير 100 مل من محلول منظم ذو pH= 10 والمتكون من محلول الأمونيا المركز وكلوريد الأمونيوم الصلب بحيث أن تركيز الملح (كلوريد الأمونيوم) يساوي 0.2M وثابت التفكك Kb = 1.75 X 10-5
خطوات التحضير
احسب حجم الأمونيا ووزن كلوريد الأمونيوم ثم حضر المحلول
- حضر المحلول من الكميات المحسوبة
قياس الرقم الهيدروجينى للمحلول المنظم
(1) أوجد درجة حرارة المحلول المنظم القياسي بغمس الترمومتر في المحلول.
(2) اضبط على جهاز pH-meter درجة الحرارة و pH للمحلول المنظم القياسي.
(3) اغمس القطب في المحلول المنظم الذي حضرته.
(4) أدخل درجة حرارة المحلول في جهاز pH-meter
(5) سجل الرقم الهيدروجيني للمحلول المنظم الذي حضرته.