التفاعلات التى تكون غازات
ينتج عن هذا النوع من تفاعلات الإحلال المزدوج تكوين غازات مثل CO2 , HCN , H2S.
مثال (1): حمض الهيدروكلوريك + بمحلول كبريتيد الليثيوم
- عندما تخلط حمض الهيدروكلوريك HI بمحلول كبريتيد الليثيوم Li2S يتصاعد غاز كبريتيد الهيدروجين H2S كما ينتج يوديد الليثوم LiI الذي يظل ذائباً فى المحلول.
(2HI(aq) + Li2S(aq) → H2S(g) ↑ + 2LiI(aq
- وماعدا H2S فإن جميع المواد في التفاعل توجد على شكل أيونات. لذا يمكنك كتابة المعادلة الأيونية الكاملة للتفاعل على النحو الآتي:
(2H+(aq) + 2I −(aq) + 2Li+(aq) + S2−(aq) → H2S(g) + 2Li+(aq) + 2I −(aq
- وبحذف الأيونات المتفرجة يمكنك الحصول على المعادلة الأيونية النهائية للتفاعل وهي:
(2H+(aq) + S2-(aq) → H2S(g
مثال (2): صودا الخبز + حمض الخليك
- ومن التفاعلات التى تنتج غاز ثاني أكسيد الكربون أيضاً ما يحدث فى المطبخ عندما تخلط الخل بصودا الخبز. فالخل محلول مائي لحمض الخليك، وصودا الخبز عبارة عن بيكربونات الصوديوم . وعند خلطهما معاً يتفاعلان ويتصاعد غاز CO2.

- وفي الحالات جميعها يجب أن يحدث تفاعلان متزامنان في المحلول لينتج غاز ثاني أكسيد الكربون . أحد هذين التفاعلين تفاعل إحلال مزدوج، والآخر تفاعل تفكك.
مثال (3): بيكربونات الصوديوم + حمض الهيدروكلوريك
- فعندما تذيب بيكربونات الصوديوم مثلاً في حمض الهيدروكلوريك يحدث إحلال مزدوج وينتج غاز.
- فكلوريد الصوديوم مادة أيونية تبقى فى الماء على شكل أيونات منفصلة. أما حمض الكربونيك H2CO3 فيتفكك بمجرد تكونه إلى ماء وغاز ثاني أكسيد الكربون. فالهيدروجين فى حمض الهيدروكلوريك ، والصوديوم في كربونات الصوديوم الهيروجينية بحل كل منهما محل الآخر.
(HCl(aq) + NaHCO3(aq) → H2CO3(aq) + NaCl (aq
لكن بمجرد أن يتكون حمض الكربونيك H2CO3 يتفكك مكوناً الماء وغاز ثاني أكسيد الكربون. وهذا عكس ما يحدث للمواد الأيونية ومنها كلوريد الصوديوم، حيث تبقى أيوناتها منفصلة فى المحلول.
(H2CO3(aq) →H2O(l) + CO2(g
لذلك يمكن جمع المعادلات كالتالي:
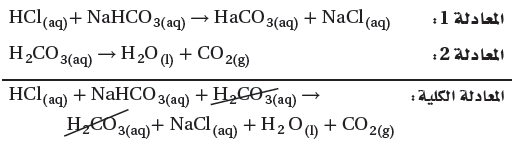
وتكون المعادلة النهائية للتفاعل:
(HCl(aq) + NaHCO3(aq) → H2O(l) + CO2(g) + NaCl(aq
ويمكنك كتابة المعادلة الأيونية الكاملة للتفاعل السابق كالآتي:
(H+(aq) + Cl-(aq) + Na+(aq) + HCO-3(aq) → H2O(l) + CO2(g) + Na+(aq) + Cl- (aq
وتلاحظ أن أيونات الصوديوم وأيونات الكلور هي الأيونات المتفرجة لذلك يمكن حذفها من طرفي المعادلة وكتابة المعادلة الأيونية النهائية للتفاعل كالآتي:
(H+(aq) + HCO-3(aq) → H2O(l) + CO2(g
تمرين محلول: اكتب التفاعل والمعادلات الكيميائية والأيونية بين حمض الهيروكلوريك ومحلول كبريتيد الصوديوم والذي ينتج غاز كبريتيد الهيدروجين ومحلول كلوريد الصوديوم.
