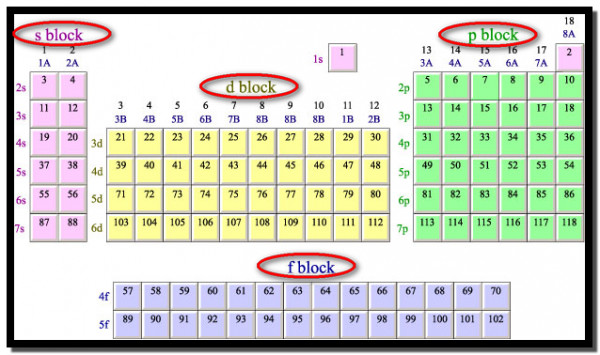
تكوين الجدول الدوري
- يتكون الجدول الدوري من سبع صفوف أفقية (Horizontal Rows) تسمي بالدورات (Periods) وثمانية عشر صفاً عمودياً تسمي بالمجموعات (Groups).
الدورات
- يتكون الجدول الدوري من سبع صفوف أفقية (Horizontal Rows) تسمي بالدورات (Periods).
- تترتب فيه عناصر الجدول الدوري حسب الزيادة في العدد الذري من اليسار إلى اليمين
- تبدأ كل دورة بذرة عنصر تمتلك إلكتروناً واحداً فقط في غلافها التكافئي وتنتهي بذرة عنصر تمتلك غلاف تكافئياً تاماً.
- توصف الدورات الثلاث الأولي بالدورات القصيرة حيث تتشكل من 2,8,8 عناصر على التوالي.
- الدورة الرابعة والخامسة تتشكل كل منها من 18 عنصراً
- أما الدورة السادسة فتتشكل من 32 عنصراً بينما الدورة السابعة تتشكل من 22 عنصراً .
- أغلب عناصر الدورة السابعة عناصر مشعة غير طبيعية.
المجموعات
- يتكون الجدول الدوري من ثمانية عشر صفاً عمودياً تسمي بالمجموعات (Groups). ثمانية مجموعات رأسية وعشرة فرعية
- عناصر المجموعة الواحدة تتشابه في خواصها الكيميائية.
- توصل الاتحاد العالمي للكيمياء النظرية والتطبيقية IUPAC عام 1984م إلى اعتماد الأرقام العربية (1,2,3,4,…..) بدلاً من الأرقام الرومانية (I,II,III,IV,…..) في ترقيم المجموعات.
تقسيم الجدول الدوري
يمكن تقسيم الجدول الدوري إلى أربعة مجمعات رئيسية وذلك حسب نوع الغلاف الثانوي الأخير الذي يظهر في الترتيب الإلكتروني لذرات العناصر التي تشكل هذه المجمعات:
(1) عناصر الفئة S ( المجمع) S-Block element
- ينتهي الترتيب الإلكتروني لذرات عناصر هذا المجمع بالغلاف الثانوي S .
- وعناصر هذه المجموعة مبينة في الجانب الأيسر من الجدول الدوري.
- يتكون هذا المجمع من مجموعتين من العناصر التي تسمي بالمعادن الخفيفة (Light Metals).
(أ) مجموعة المعادن القلوية (Alkali metals) – وتشمل المجموعة IA
(ب) مجموعة معادن الأتربة القلوية (alkali earth metals) – وتشمل المجموعة IIA
(2) عناصر الفئة P ( المجمع) P-Block element
- ينتهي الترتيب الإلكتروني لذرات عناصر هذا المجمع بالغلاف الثانوي P .
- عناصر هذه المجموعة مبينة في الجانب الأيمن من الجدول الدوري
- ويضم هذا المجمع ست مجموعات ( من المجموعة 13- إلى المجموعة 18) حيث تسمى المجموعة الثامنة عشرة (أو أحياناً تسمى المجموعة الصفرية) بمجموعة الغازات المثالية ، أما المجموعة السابعة عشر فتسمى بمجموعة الهالوجينات.
(3) عناصر الفئة d ( المجمع) d-Block element
- ينتهي الترتيب الإلكتروني لذرات عناصر هذا المجمع بالغلاف الثانوي d تسمى العناصر التي ينتهي الترتيب الإلكتروني لذراتها أو أحد أيوناتها بالغلاف ndx (حيث X= 1 إلى 9) بالعناصر الانتقالية الأساسية. وتشتمل هذا المجمع على ثلاث سلاسل Series من العناصر وهي:
(أ) السلسلة الانتقالية الأولي 3d
ينتهي الترتيب الإلكتروني لعناصر هذه المجموعة بـ 3dx ( حيث يشير x إلى عدد الإلكترونات ، x= 1 إلى 9 ولا تساوي صفر أو 10).
(ب) السلسلة الانتقالية الثانية 4d
ينتهي الترتيب الإلكتروني لعناصر هذه المجموعة بـ 4dx ( حيث يشير x إلى عدد الإلكترونات ، x= 1 إلى 9 ولا تساوي صفر أو 10).
(جـ) السلسلة الانتقالية الثالثة 5d
ينتهي الترتيب الإلكتروني لعناصر هذه المجموعة بـ 5dx ( حيث يشير x إلى عدد الإلكترونات ، x= 1 إلى 9 ولا تساوي صفر أو 10). وعلى الرغم من أن هذه السلسلة تبدأ بلنثينوم (La57) إلا أنه لا يعتبر أحد أعضاء هذه السلسلة
(4) عناصر الفئة f ( المجمع) f-Block element
ينتهي الترتيب الإلكتروني لذرات هذا المجمع بالغلاف الثانوي f حيث تسمى عناصر هذا المجمع بالعناصر الانتقالية الداخلية (Inner-transition element) ، يتكون هذا المجمع من سلسلتين من العناصر وهما:
(أ) سلسلة اللانثنايد (Lanthanide series):
ينتهي الترتيب الإلكتروني لذرات هذه السلسلة بالغلاف 4f
(ب) سلسلة الإكتنايد (Actinide series) :
ينتهي الترتيب الإلكتروني لذرات هذه السلسة بالغلاف الثانوي 5f
تسمى عناصر المجمع d ، وعناصر المجمع f بالمعادن الثقيلة (Heavy Metals).