تكوين الأيون الموجب Positive Ion Formation
- يتكون الايون الموجب عندما تفقد الذرة إلكترون تكافؤ واحدًا أو أكثر لتحصل على التوزيع الألكتروني المشابة للتوزيع الالكتروني لأقرب غاز خامل.
- يسمى الأيون الموجب بالكاتيون Cation.
- لفهم تكوين الأيون الموجب قارن بين التوزيع الإلكتروني لغاز النيون النبيل (العدد الذري يساوي 10) والتوزيع الإلكتروني لفلز الصوديوم القلوي (العدد الذري يساوي 11)
Ne10: 1s2 2s2 2p6
Na11 : 1s2 2s2 2p6 3s1
Na+ : 1s2 2s2 2p6
- لذرة الصوديوم إلكترون تكافؤ واحد في المستوى 3s ولذا فهي تختلف عن ذرة غاز النيون النبيل بهذا الألكترون الإضافي.
- عندما تفقد ذرة الصوديوم هذا الإلكترون، تحصل على توزيع إلكتروني مستقر مشابة مشابه للتوزيع الإلكتروني لذرة النيون.
- يوضح الشكل التالي كيف تفقد ذرة الصودؤوم إلكترون التكافؤ لتتحول إلى كاتيون:

- من الضروري معرفة أنه رغم حصول ذرة الصوديوم على توزيع إلكتروني مشابه للتوزيع الإلكتروني لذرة النيون إلا أنها لم تتحول إلى ذرة نيون، بل تحولت إلى أيون صوديوم أحادي الشحنة الموجبة، وأن عدد البروتونات (11) الذي يميز ذرة الصوديوم ما زال ثابتًا داخل النواة لم يتغير.
الأيونات الموجبة للفلزات Positive ions of metals
- إن ذرات الفلزات نشيطة كيميائيًّا؛ لأنها تفقد إلكترونات تكافئها بسهولة.
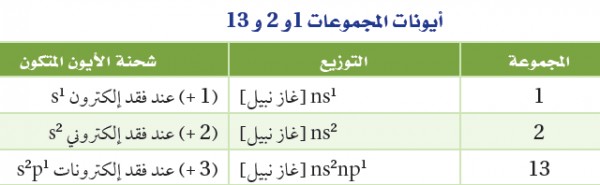
- فلزات المجموعتين الأولى والثانية أكثر الفلزات نشاطًا في الجدول الدوري وتكون أيونات موجبة.
فعلى سبيل المثال، تُكوِّن فلزات البوتاسيوم والماغنسيوم الموجودة فى المجموعتين 1 ،2 الأيونات +Mg+2 ، K
- تكون بعض ذرات عناصر المجموعة 13 أيونات موجبة أيضاُ.
- يلخص الجدول التالي الأيونات التي تكوّنها ذرات فلزات المجموعات 1 ، 2 ، 13 :