الشبكة البللورية Crystalline Structure
- تحدد الروابط الكيميائية في المركب الكثير من خصائصه.
على سبيل المثال، تكون الروابط الأيونية بناءات فيزيائية فريدة للمركبات الأيونية لا تشبه المركبات الأخرى.
- يساهم البناء الفيزيائي للمركبات الأيونية في تحديد خصائصها الفيزيائية التي استخدمت في استعمالات متعددة.
- يحتوي البناء الفيزيائي للمركبات الأيونية على عدد كبير من الأيونات الموجبة والسالبة، ويتحدد عددها بنسبة عدد الإلكترونات التي تنتقل من ذرات الفلز الى ذرات اللافلز. وتترتب هذه الأيونات بنمط متكرر يحفظ التوازن بين قوى التجاذب والتنافر بينها.
- تفحص نمط ترتيب الأيونات في بلورة كلوريد الصوديوم، كما تظهر في الشكل التالي ولاحظ التنظيم الدقيق لشكل البلورة الأيونية، حيث المسافات ثابتة بين الأيونات، والنمط المنظم الذي تترتب فيه. وعلى الرغم من أن أحجام الأيونات غير متساوية إلا أن كل أيون صوديوم محاط بستة أيونات كلوريد، وكذلك كل أيون كلوريد محاط بستة أيونات صوديوم. وتتكون بلورة مكعبة الشكل.
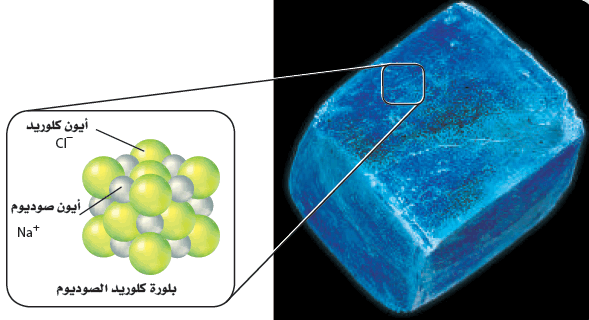
- تتكون وحدة بناء البلورة من أيون صوديوم وأيون كلوريد، بل من عدد كبير من أيونات الصوديوم والكلوريد التي توجد معاً.
- تتكون الشبكة البلورية نتيجة لقوة الجذب الكبيرة بين الأيونات الموجبة والأيونات السالبة.
- الشبكة البلورية ترتيب هندسي للجسيمات ثلاثي الأبعاد. يحاط فيها الأيون الموجب بالأيونات السالبة، كما يحاط الأيون السالب بالأيونات الموجبة. وتختلف البلورات الأيونية في شكلها بسبب حجم الأيونات وأعدادها المترابطة كما في الشكل التالي:

طاقة الشبكة البلورية Lattice energy
- طاقة الشبكة البلورية هي الطاقة اللازمة لفصل أيونات 1mol من المركب الأيوني.
- وفي هذه الحالة ينظر إليها على أنها طاقة ممتصة، وتشير إلى قوة تجاذب الأيونات التي تعمل على تثبيتها في أماكنها، حيث تزداد طاقة الشبكة البلورية بزيادة قوة التجاذب.
- ويمكن النظر إلى طاقة الشبكة البلورية على أنها الطاقة المنبعثة عند اتحاد واحد مول من المركب الأيوني، وفي هذه الحالة ينظر إليها على أنها طاقة منبعثة.
- وتجدر أيونات الإشارة إلى أن قيمة الطاقة الممتصة تكون موجبة، في حين تكون قيمة الطاقة المنبعثة سالبة.
- تتوقف طاقة الشبكة البللورية على حجم الأيون ومقدار شحنته
(1) علاقة طاقة الشبكة البلورية بمقدار شحنة الأيون
- إذ عادة ما تكون طاقة الشبكة البلورية التي تتكون من أيونات كبيرة الشحنة أكبر من طاقة الشبكة البلورية التي تتكون من أيونات صغيرة الشحنة.
- لذا تكون طاقة MgO أكبر أربع مرات من طاقة NaF لأن شحنة الأيونات في MgO أكبر من شحنة الأيونات في NaF لأن شحنة الأيونات في MgO أكبر من شحنة الأيونات في NaF
- تقع طاقة الشبكة البلورية SrCl2 بين طاقة الشبكة البللورية MgO والشبكة البلورية NaF وذلك لأن الشبكة البلورية SrCl2 تحتوى على أيونات ذات شحنة موجبة عالية وأيونات ذات شحنة سالبة منخفضة معًا.
(2) علاقة طاقة الشبكة البللورية بحجوم الأيونات
- ترتبط طاقة الشبكة البلورية بصورة مباشرة بحجوم الأيونات المرتبطة معاً.
- الأيونات الصغيرة الحجم تكون مركبات أيوناتها متراصة أى لا يوجد بينها فراغات. ولأن التجاذب بين الشحنات المختلفة تزداد كلما قلت المسافة بينها فإن الأيونات الصغيرة تكوِّن قوى تجاذب كبيرة وطاقة شبكة بلورية كبيرة.
- على سبيل المثال، طاقة الشبكة البلورية لمركب الليثيوم أكبر من طاقة الشبكة البلورية لمركب البوتاسيوم الذي يحتوي على الايون السالب نفسه. ويعود السبب في ذلك؛ إلى أن حجم أيون الليثيوم أصغر من حجم أيون البوتاسيوم.
- الجدول التالي يبين طاقات الشبكات البلورية لبعض المركبات الأيونية.

عند تفحص طاقات الشبكات البلورة لكل من RbF ، KF فى الجدول السابق تجد أن طاقة الشبكة البلورية KF أكبر من طاقة الشبكة البلورية RbF لأن نصف قطر +K أصغر من نصف قطر +Rb وهذا يؤكد أن طاقة الشبكة البللورية مرتبطة مع حجم الأيون.