الرابطة الثلاثية Triple Bond
- ومن أشهر الأمثلة على الرابطة الثنائية جزيء الأسيتيلين C2H2.
- وسوف يتم توضيح كيفية تكون الروابط في جزيء C2H2 كما يلي :
(1) نكتب التركيب الإلكتروني لذرة الكربون في الحالة المستقرة (المنفردة):
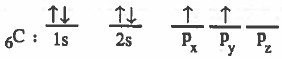
(2) التركيب الإلكتروني لذرة الكربون في الحالة المثارة:
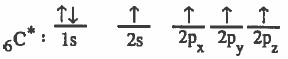
(3) يحدث دمج (تهجين) بين المجال (2s) والمجال (2px) لينتج مجالين مهجنين متساويين في الشكل والطاقة كل منها يسمى sp ويبقى المجال 2pz والمجال 2py دون تهجين ويكونان عـمـوديين على المستوى الذي يمر بالمجالات sp وفي نفس الوقت متعامدين مع بعضهما البعض كما يلي:
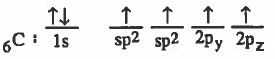
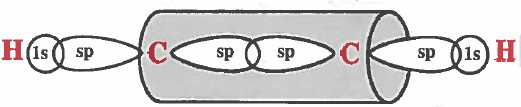
وبعد ذلك يحدث نوعان من التداخل وهما :
(1) تداخل رأسي والروابط فيه من نوع سيجما (σ) كما يلي :
- التداخل بين المجالين ( sp - sp ) وينتج عنه رابطة بين (C-C).
- التداخل بين المجالين ( 1s - sp) وينتج عنه رابطة بين ( C-H).
(2) تداخل جانبي والروابط فيه من نوع باي (π) كما يلي :
- التداخل بين المجالين ( 2pz - 2pz) لينتج عن ذلك رابطة بين (C-C).
- في التداخل بين المجالين ( 2py - 2py) لينتج عن ذلك رابطة بين (C-C).
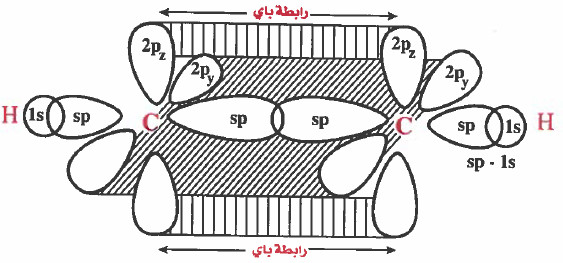
ملاحظة : نتيجة لوجود تداخل للمجالات من جميع الجوانب لذا سوف تتكون سحابة إلكترونية من الأعلى ومن الأسفل ومن جانبين حول ذرة الكريون أي على شكل أسطوانة كما في الرسم التالي:
كيفية تكون الرابطة التساهمية من نوع (π) في جزيء النيتروجين N2
- التركيب الإلكتروني لذرة النيتروجين:
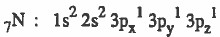
- نلاحظ أن ذرة النيتروجين تحتوي على ثلاث مدارات ذرية ( 2p ) وكل مـدار يـحـتـوي على إلكترون منفرد
- أحد المدارات الذرية يتداخل رأسياً ، أما المداران الآخران فيحدث لهما تداخل جانبي وبذلك سوف تتكون السحابة الإلكترونية أعلى وأسفل النواتين وينتج عن هذا التداخل تكون الرابطة التساهمية. وهذه الرابطة تسمى باي ويرمز لها بـ (π).
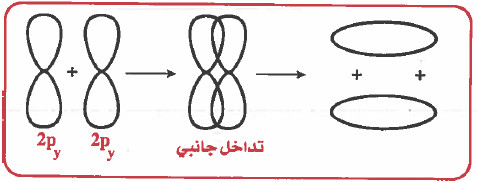
- ويحدث التداخل الجـانبي في الجزيئات التي تحتوي على روابط ثنائية أو ثلاثية ، مثل:
H-C ≡ C-H , CO2 , CH2 =CH2 , O2
ملاحظة: التداخل في مدارات سيجما أكبر من مدارات باي ولذلك فإن الرابطة سيجما أقوى من الرابطة باي.