الخواص الفيزيائية للأحماض الكربوكسيلية
(1) الحالة الفيزيائية Physical state
- الأحماض التي تحتوي على ذرة كربون واحدة إلى أربع ذرات كربون تكون سوائل خفيفة.
- الأحماض التي تحتوي على خمس إلى تسع ذرات كربون عبارة عن سوائل ثقيلة.
- الأحماض التي تتكون من عشر ذرات كربون فأكثر تكون في الحالة الصلبة.
(2) الكثافة Density
- تقل كثافة الأحماض الكربوكسيلية بزيادة الوزن الجزيئي لها.
- حمض الفورميك والأستيك هم فقط الأكبر كثافة من الماء عند درجة حرارة 20Co
- باقى الأحماض الكربوكسيلية أقل كثافة من الماء. (أنظر الجدول الموجود فى درجات الانصهار والغليان).
(3) الرائحة odor
(أ) رائحة الأحماض الكربوكسيلية التسعة الأولى هي عبارة عن سوائل ذات روائح حادة وغير مقبولة مثل:
- حمض الفورميك الذي يتميز بطعم لاذع وهو احد المكونات لللسعات النحل .
- حمض الخليك فيضفي على الخل لذعته ورائحته المميزتان .
- حمض بيوتانويك المسبب في رائحة الزبدة المتعفنة.
- حمض اللكتيك فيتكون عند تخثر الحليب وكذلك نتيجة إجهاد العضلات بالإضافة إلى انه يكون ناتج عن التحلل البكتيري للسكروز الذي تقوم به بعض الكائنات في اللثة والأسنان .
- حمض هكسانويك فله رائحة شعر الماعز وإفرازاته.
(ب) الأحماض التي تحتوي على عشر ذرات كربون فأكثر فهي مواد شمعية ولا تتميز بروائح معينة.
(4) القطبية Polarity
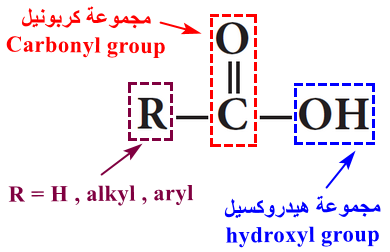
- تعتبر الأحماض الكربوكسيلية من الجزئيات عالية القطبية.
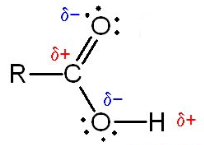
- تحتوى على مجموعتى قطبيتين وهما مجموعة الكربونيل (C=O) ومجموعة الهيدروكسيل (OH)
(5) درجة الغليان Boiling Point
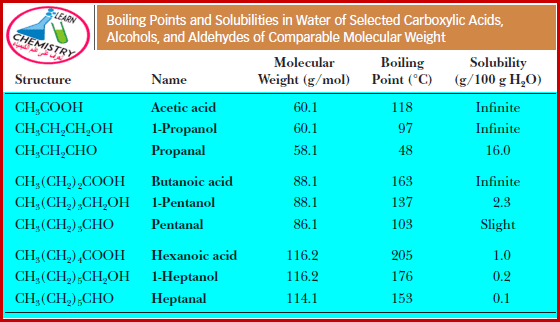
- تزداد درجات الغليان للأحماض الكربوكسيلية بزيادة الوزن الجزيئي لها..
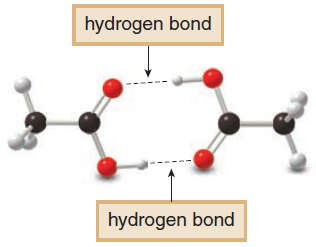
- درجتى الانصهار والغليان للأحماض الكربوكسيلية تكون عالية بسبب وجود الروابط الهيدروجينية بين جزيئاتها.
- بسبب القطبية العالية لجزئيات الأحماض الكربوكسيلية (بسبب وجود مجموعة الكربوكسيل) وقدرتها على تكوين روابط هيدروجينية بين جزئياتها تكون ذات درجات غليان عالية جداً حيث تكون جزئ يعرف بالجزيء المضاعف dimer وهو عبارة عن ترابط جزيئين من جزئيات الأحماض الكربوكسيلية برابطة هيدروجينية فتصبح كأنها جزئ واحد.
- درجتى الانصهار والغليان للأحماض الكربوكسيلية أعلى منها فى المركبات العضوية الأخرى التى لها نفس الوزن الجزيئي لأنه كلما زدات قوة القوي بين الجزيئية Intramolecular forces للمركبات زادت درجة الغليان والأنصهار.
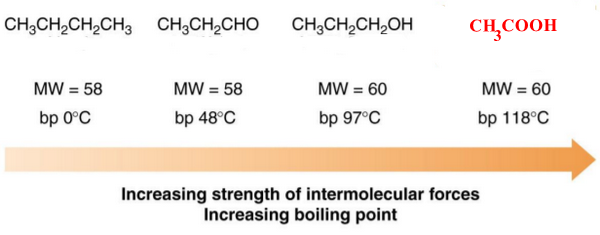
Alkanes → Van der waals forces
Aldehydes → Van der waals forces + dipole-dipole forces
Alcohols → Van der waals forces+ dipole-dipole forces + One hydrogen bond
Carboxylic acids → Van der waals forces + dipole-dipole forces + Two hydrogen bonds
- درجات الانصهار والغليان للأحماض الكربوكسيلية أعلى منها فى حالة الكحولات التى لها نفس الوزن الجزيئي وذلك بسبب القطبية العالية لمجموعة الكربوكسيل فأن الروابط الهيدرجينة تكون على نطاق أوسع منها فى حالة الكحولات.
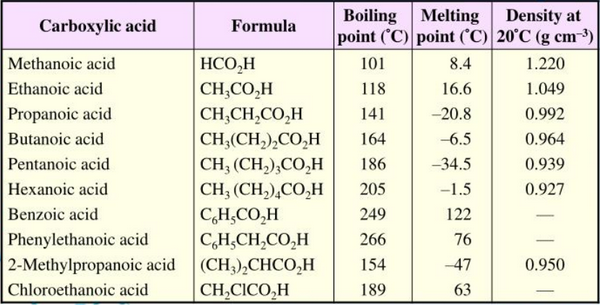
- الجدول التالي يوضح الكثافة و درجات الانصهار والغليان لبعض الأحماض الكربوكسيلية المعروفة
(6) الذوبانية Solubility
- تذوب جميع الأحماض الكربوكسيلية فى المذيبات العضوية.
- الأحماض الكربوكسيلية الخمس الأولى تذوب في الماء بسبب قدرتها على تكوين روابط هيدروجينية قوية مع جزئيات الماء.
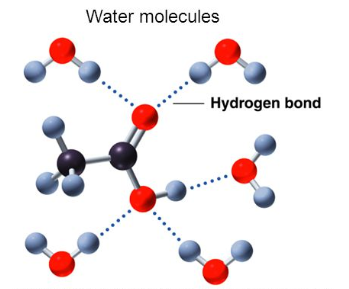
- الأحماض الكربوكسيلية التى تزيد عدد كربوناتها عن (5) ذرات كربون فهى لا تذوب فى الماء نظراً لكبر حجم مجموعة الألكيل الغير قطبية التى لا تذوب فى جزئيات الماء القطبية.
- تقل الذوبانية بزيادة الوزن الجزيئي إلى أن تصبح عديمة الذوبانية في الماء.
- تذوب جميع الأحماض الكربوكسيلية الاليفاتية والاروماتية في محلول مائي لهيدروكسيد الصوديوم وبيكربونات الصوديوم لتعطي أملاح الصوديوم .
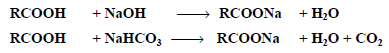
مقارنة رائعة
- الجدول التالي يوضح درجات الغليان والذوبانية في الماء للأحماض الكربوكسيلية مقارنة بالألدهيدات والكحولات التي لها نفس الوزن الجزيئي تقريباً.