درجة الغليان فى الأحماض الكربوكسيلية
- تعتبر الأحماض الكربوكسيلية من الجزئيات عالية القطبية.
- تحتوى على مجموعتى قطبيتين وهما مجموعة الكربونيل (C=O) ومجموعة الهيدروكسيل (OH)
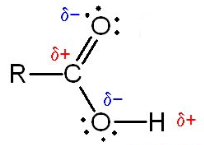
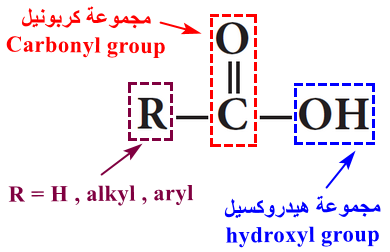
- تزداد درجات الغليان للأحماض الكربوكسيلية بزيادة الوزن الجزيئي لها..
- درجتى الانصهار والغليان للأحماض الكربوكسيلية تكون عالية بسبب وجود الروابط الهيدروجينية بين جزيئاتها.
- بسبب القطبية العالية لجزئيات الأحماض الكربوكسيلية (بسبب وجود مجموعة الكربوكسيل) وقدرتها على تكوين روابط هيدروجينية بين جزئياتها تكون ذات درجات غليان عالية جداً حيث تكون جزئ يعرف بالجزيء المضاعف dimer وهو عبارة عن ترابط جزيئين من جزئيات الأحماض الكربوكسيلية برابطة هيدروجينية فتصبح كأنها جزئ واحد.
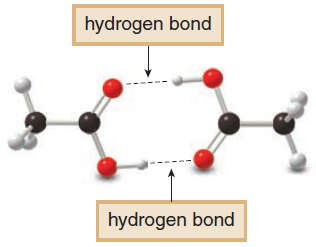
- درجتى الانصهار والغليان للأحماض الكربوكسيلية أعلى منها فى المركبات العضوية الأخرى التى لها نفس الوزن الجزيئي لأنه كلما زدات قوة القوي بين الجزيئية Intramolecular forces للمركبات زادت درجة الغليان والأنصهار.
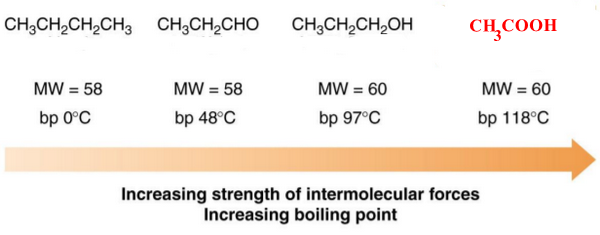
Alkanes → Van der waals forces
Aldehydes → Van der waals forces + dipole-dipole forces
Alcohols → Van der waals forces+ dipole-dipole forces + One hydrogen bond
Carboxylic acids → Van der waals forces + dipole-dipole forces + Two hydrogen bonds
- درجات الانصهار والغليان للأحماض الكربوكسيلية أعلى منها فى حالة الكحولات التى لها نفس الوزن الجزيئي وذلك بسبب القطبية العالية لمجموعة الكربوكسيل فأن الروابط الهيدرجينة تكون على نطاق أوسع منها فى حالة الكحولات.
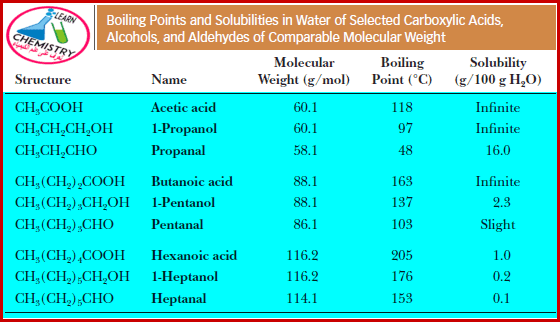
- الجدول التالي يوضح درجات الغليان والذوبانية في الماء للأحماض الكربوكسيلية مقارنة بالألدهيدات والكحولات التي لها نفس الوزن الجزيئي تقريباً.