(3) الاحتراق Combustion
- تحترق الألكينات فى الهواء بلهب مدخن (لأن نسبة الكربون فى الألكين أكبر مما فى الألكان.
- ناتج إحتراق الألكينات هو H2O ، CO2 ، طاقة
- ولا يستعمل هذا التفاعل كمصدر للطاقة نظراً لاستخدام الألكينات فى التفاعلات الأخرى.

(4) تأثير الحرارة على الألكينات
عند تسخين الألكين بوجود عامل مساعد ، فإن موقع الرابطة الزوجة يتغير ليعطي ألكيناً أكثر ثباتاً .
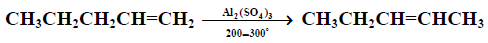
(5) تفاعل تكوين هالوهيدرين Halohydrin formation
- يتكون هالوهيدرين كناتج رئيسي عند هلجنة الألكين في محلول مائي بدلاً من رابع كلوريد الكربون.
- حيث تدخل جزيئات الماء في التفاعل نظرا لتفوقها العددي على جزيئات الهاليد فتتفاعل كنيوكلوفيل بسبب زوجي الإلكترونات غير الرابط على ذرة الأكسجين ويكون الناتج مشابها لناتج إضافة ماركونيكوف.
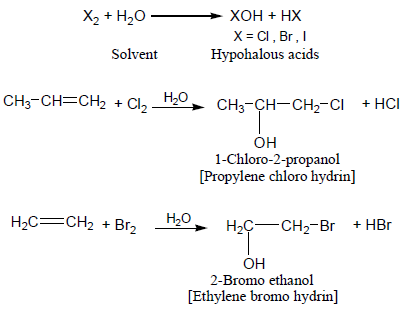
يتضح من الأمثلة السابقة أن:
- الإضافة تتم على جانبي الرابطة المزدوجة فى الألكين.
-عند وجود الألكين غير متماثل فإن ذرة الهالوجين تتصل بذرة الكربون التي تحمل العدد الأكبر من ذرات الهيدروجين في الألكين.
(6) تفاعل الألكلة Alkylation
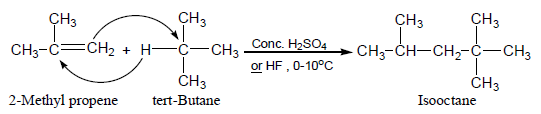
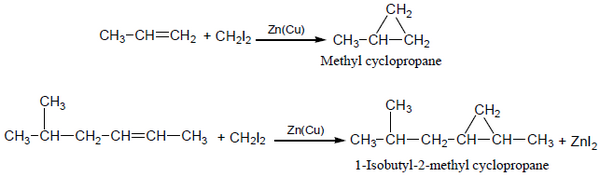
(7) تفاعل إضافة أيودات الكاربين Addition of Carbenoids
حيث يتم معالجة الألكين بــ diiodo methane CH2I2 فى وجود (Zn(Cu لتكوين حلقات ثلاثية (cyclopropane) بين ذرتى كربون الرابطة المزدوجة.
- يطلق على هذا التفاعل تفاعل سيمون – سيمث Simmons-Smith reaction
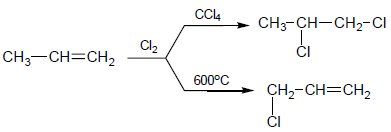
(8) تفاعل الهلجنة والاستبدال الأليلي Halogenation , Allylic substitution
- عند الهلجنة في الطور الغازي ودرجة حرارة مرتفعة أو تسليط ضوء مناسب فأن الهلجنة تتم فى مجموعة الميثيل ولا تتم إضافة الهالوجين على الرابطة الزوجية .
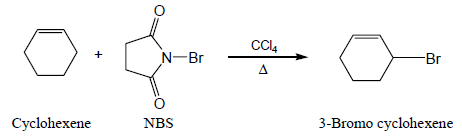
- يمكن استخدام (N-Bromo succinimide (NBS لهلجنة الألكينات بالبروم فى الموقع الأليلي دون أن يؤثر على الرابطة المزدوجة .
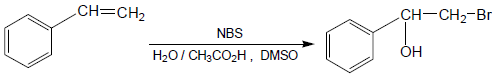
- عند استخدام كاشف NBS فى وجود الماء والمذيب المناسب مثل dimethyl sulfoxide - DMSO ينتج بروموهيدرين.
(9) تفاعلات شطر الألكينات Cleavage of alkenes
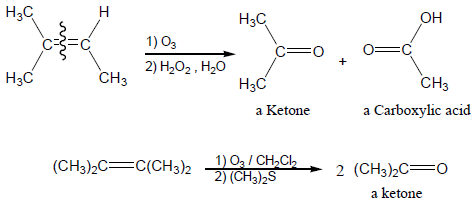
(أ) التفاعل مع الأوزون Ozonization
- يتفاعل الأوزون بقوة مع الألكين ويعطي مركبات تسمى أوزونايد Ozonide التي يتم اختزالها بالخارصين Zn أو dimethyl sulfide (CH3)2S إلى الدهيدات أو كيتونات.

- عند إعادة أكسدة مركبات الأوزونايد باستخدام H2O2 يتم تحويلها إلى أحماض كربوكسيلية وكيتونات.
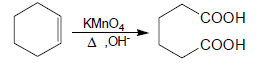
(ب) التفاعل مع برمنجنات البوتاسيوم Potassium permanganate KMnO4
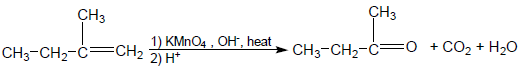
- تتفاعل البرمنجنات مع الألكين على الساخن في محلول مركز من أيون البرمنجنات فينتج كيتونات وأحماض كربوكسيلية.
- في حالة وجود مجموعة طرفيه –CH2- فأنها تتأكسد إلى CO2.
(جـ) التفاعل مع رابع أوكسيد الأوزميوم Osmium tetroxide OsO4
- يتم التفاعل فى وجود -Periodate ion IO4 فتنشطر الرابطة الزوجية وتعطي نفس الأنواع من نواتج الانشطار بالأوزون التي تنتج بالاختزال (الدهيدات أو كيتونات )
- تسمى نواتج هذا التحول (أو الانشطار) بــ Lemeiux-.Johnson cleavage
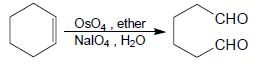
(10) تفاعلات تضاعف الألكينات Dimerization of alkenes
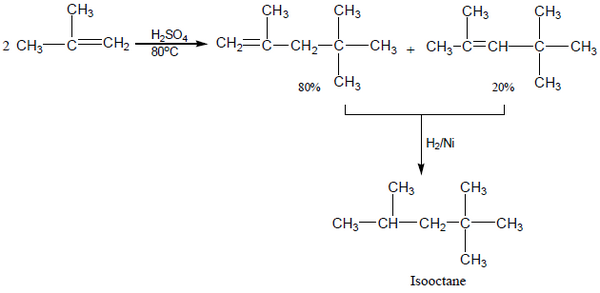
عند تفاعل isobutylene (صيغته الجزيئية C4H8) مع حمض معدني مثل حمض الكبريتيك أو الفسفوريك يتكون مزيج من جزيئين لألكين مضاعف Dimer (صيغته الجزيئية C8H16).
- هذا التفاعل مهم فى الصناعة النفطية حيث تعطي هدرجة هذا المزيج مركباً واحد وهو isooctane
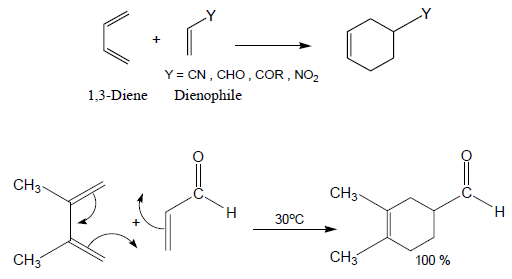
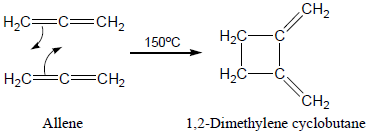
(11) تفاعل الإضافة الحلقية Cycloadition reaction
- يعرف هذا التفاعل بتفاعل ديلز-ألدر Diels -Alder reaction نسبة للعالمين الألمانيين Otto Diels ، Kurt Alder
- هو عبارة عن تفاعل تضاف فيه الألكينات إلى بعضها أو إلى الدايينات (مركبات تحتوى على رابطتين مزدوجتين) لتكوين مركبات حلقية.
- تكون المتفاعلات الأساسية في هذا التفاعل هي ألكين مع 1,3diene حيث يسمى الألكين الذي يتحد مع الدايين في هذا التفاعل باسم "dienophile" أى المحب للدايين "diene lover"
- عند وجود مجموعة ساحبة للإلكترونات electron-withdrawing group على الرابطة الزوجيةdienophile يزداد مردود هذا التفاعل بشكل اكبر.