تفسير خاصية اللون فى المواد
- من المعروف أن لون المادة ينتج من امتصاص بعض فوتونات منطقة الضوء المرئي والذى تراه العين هو محصلة مخلوط الألوان المتبقية (المنعكسة)
- فإذا امتصت المادة جميع ألوان الضوء المرئي (الأبيض) تظهر للعين سوداء وإذا لم تمتص أياً منها ظهرت بيضاء - وعندما تمتص المادة لوناُ معيناُ يظهر لونها باللون المتتم له.
- يسمى اللون التى تمتصه المادة باللون الممتص.
- يسمى اللون التي لم تمتصه المادة باللون المتتم Complementary color
- عندما تمتص المادة جميع الألوان (اللون الأبيض تظهر باللون الأسود)
- عندما لا تمتص المادة أى لون من الألوان تظهر باللون الأبيض.
- إذا امتصت المادة لون معين من ألوان الطيف تظهر المادة باللون المتمم
- عندما تتحد مادة مع اللون المتمم تظهر المادة باللون الأبيض
- الشكل التالي يوضح العلاقـة بيـن اللـون المتتـم واللــون الممتص

فمثلاُ مركبات الكروم (III) تمتص اللون الأحمر لذا يظهر لونها باللون الأخضر.
- يعتمد لون المادة على خصائص وميزات فيزيائية وكيميائية.
أولاُ/ الخواص الفيزيائية
(1) الامتصاص (Absorption)
- المادة السائلة أو الصلبة الشفافة ستعمل على إمرار كل الألوان المكونة للضوء الأبيض دون تغير وبالتالي ستظهر المادة بلا لون.
- أما المواد التي تمرر أو تعكس قسماً من الضوء الأبيض وتمتص القسم الآخر فستظهر ملونة. وعادة ما تسمى الألوان التي انعكست أو نفذت عبر المادة بالألوان المكملة (Complementary colors).
(2) الانعكاس والانتشار (Diffuse and Reflectance)
- عندما تسقط حزمة من الأشعة الضوئية على السطوح الخشنة فإنها تعكسها في اتجاهات متعددة، فمثلاً ملح الطعام نراه ذو لون أبيض لأن بلوراته تعكس الضوء دون أي امتصاص للأشعة.
- وفي المقابل إنّ أملاح كبريتات النحاس تظهر بلون أزرق لأنها تمتص أغلب الأطوال الموجية للضوء كالأحمر والأصفر وغيرها وتعكس الأطوال الموجية الزرقاء فقط.
(3) تبعثر الضوء (Light Scattering)
- يتبعثر الضوء عند اصطدامه بجسيمات تكون في طريق انتشاره.
- من الأمثلة الأكثر شهرة هي اللون الأزرق للسماء.
- إنّ الأطوال الموجية الزرقاء المنبعثة من ضوء الشمس تتبعثر بشكل أكبر من الأطوال الموجية الحمراء نتيجة اصطدامها بجسيمات صغيرة في الحجم (أصغر من الأطوال الموجية للضوء).
- أما الجسيمات ذات أنصاف الأقطار الأكبر من الأطوال الموجية للضوء أو التي تكون من رتبة الأطوال الموجية للضوء تسبب تبعثر الضوء ولا تؤثر كثيراً على اللون لذلك نرى الغيوم و الملوثات في الهواء ذات لون أبيض قاتم.
ثانياُ/ الخواص الكيميائية
- تتألف المواد جميعها من ذرات أو مجموعة من الذرات المرتبة على شكل جزيئات. بعض هذه الأشكال المرتبة أو المسماة المجموعات الوظيفية تكون مسؤولة عن لون المركب.
- مثل هذه المجموعات تسمى بالكروموفورات (Chromophores). يكون هذا الكروموفور قابلاً للانتقال الالكتروني عند تعرضه للأطوال الموجية للطيف المرئي والفوق بنفسجي (UV – visible) وبهذا الانتقال الالكتروني يعطي المركب لوناً مميزاً
- من الأمثلة على مثل هذه المركبات بيتا كاروتين (ß-Carotene ) والكيونونات (Quinonones) و أصباغ الآزو والبورفيرينات (Porphyrins).
ألوان العناصر الانتقالية
- تمتاز عناصر السلسلة الانتقالية الأولى بأن مركباتها ومحاليل مركباتها في الماء لها ألوان مختلفة.
- يظهر لون المادة بسبب أن المادة تمتص بعض فوتونات الضوء المرئي ولا تمتص البعض الآخر فيظهر لون المادة بمحصلة الألوان التى لم تمتصها.
- يتكون الضوء الأبيض من (7) ألوان مرئية لكل منها طاقة معينة.
- تتميز العناصر الانتقالية بأن المستوى الفرعي (d)غير مكتمل بالإلكترونات أي يحتوى على إلكترونات مفردة هذه الإلكترونات سهلة الإثارة.
- عندما يسقط الضوء الأبيض على تجمع ذرى أو الجزيئات فان الإلكترونات المفردة للذرات أو الجزيئات تمتص فوتونات الضوء التى تتفق طاقته مع الطاقة اللازمة لإثارة الإلكترونات وترتد الفوتونات التى لم تمتص فتسبب للعين الإحساس بلون هذه المادة.
العلاقة بين ألوان أيونات العناصر الانتقالية وتركيبها الألكتروني
- يوضح الجدول التالي بعض الأيونات المتهدرتة لفلزات السلسلة الانتقالية الأولي:
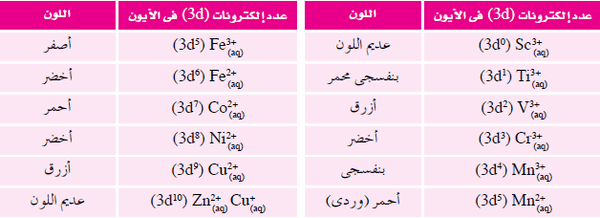
- وبمراجعة الجدول السابق نجد أن أيونات +d10) Zn2+ ، (d10) Cu1+ ، (d0) Sc3) غير ملونة.
- أيونات العناصر غير الانتقالية فهي تتميز أما باحتوائها على أوربتالات (d) فارغة (d0) أو ممتلئة تماماً (d10).
- من ذلك نستنتج أن اللون في أيونات العناصر االانتقالية يعزي إلى الامتلاء الجزئي (1:9e) لأوربتالات المستوى الفرعي (d) أى لوجود إلكترونات منفردة في أوربتالات (d).
ملاحظات هامة
(1) تكون الأيونات غير ملونة عندما تكون أوربيتالات (d) فارغة أو ممتلئة بالإلكترونات d10 & d0
(2) تكون الأيونات ملونة عندما يكون المستوى الفرعي (d) غير ممتلئ بعشرة إلكترونات من 1 إلى 9
(3) أيونات العناصر الغير انتقالي غير ملونة لان اوربيتالات المستوى الفرعى (d) فارغة من الإلكترونات والطاقة اللازمة لإثارة الإلكترونات المفردة فى اوربيتالات P & S أعلى من طاقة الضوء المرئي.
(4) أيون Cu+1 عديم اللون ولكن Cu+2 ازرق اللون وذلك لأن Cu+1 عديم اللون لان جميع الاوربيتالات فى المستوى الفرعي (3d) ممتلة بالإلكترونات Ar] 3d104S0] ، أما Cu+2 لونه ازرق لان ايونه امتص اللون البرتقالي وعكس اللون المتتم وهو اللون الأزرق لان اوبيتالات المستوى الفرعي (3d) غير تامة الامتلاء بالإلكترونات Ar]3d9 4S0] وتحتوى على إلكترون مفرد
(5) أيونات الصوديوم والبوتاسيوم غير ملونة لأن اوربيتالات المستوى الفرعي (d) فارغة من الإلكترونات والطاقة اللازمة لإثارة الإلكترونات المفردة فى اوربيتالات P&S أعلى من طاقة الضوء المرئي.
(6) أيون Ti +3 بنفسجي محمر ولكن أيون Ti +4 غير ملون لأن Ti+3 تركيبه الإلكتروني Ar]18 3d1 4S0] لأن به إلكترون مفرد فى أوربيتالات المستوى الفرعي (3d) يؤدى ذلك إلى امتصاص اللون الأخضر وينعكس اللون البنفسجي المحمر أما أيون Ti+4 غير ملون لأن تركيبه الإلكتروني Ar] 3d0 4S0] فيكون المستوى الفرعي (3d) خالي من الإلكترونات.