جهد التأين (طاقة التأين) Ionization energy
مقدار الطاقة اللازمة لإزالة أو فصل أقل الإلكترونات ارتباطاً بالذرة المفردة وهى في الحالة الغازية.
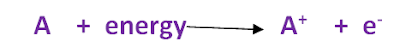
ملاحظات هامة على جهد التأين
(1) جهد التأين ماص للحرارة ( + )
(2) قد يوجد للعنصر أكثر من جهد تأين لأنه من الممكن إزالة إلكترون أو أثنين أو ثلاثة من الذرة فقد يوجد للذرة جهد تأين أول وثان وثالث.... الخ
(3) جهد التأين الأول للغازات النبيلة مرتفع جداً لإستقرار نظامها الإلكتروني حيث يصعب إزالة إلكترون من مستوي طاقة مكتمل
(4) جهد التأين الثاني أكبر من جهد التأين الأول وذلك لزيادة شحنة النواة عن شحنة الألكترونات المتبقية فى الذرة مما يزيد من قوة جذب النواة للإلكترونات
(5) الجهد الـتأين الثالث يكون أكبر من جهدى التأين الأول والثاني وذلك لأنه قد يتسبب فى كسر مستوى طاقة مكتمل كما فى ذرة الماغنسيوم

تدرج جهد التأين للعناصر في الجدول الدوري
(1) في الدورات الأفقية :-
تزداد قيم جهد التأين كلما اتجهنا ناحية يمين الجدول أي بزيادة العدد الذرى
السبب في ذلك:- نقص نصف قطر الذرة (نقص الحجم) مما يؤدى إلى اقتراب إلكترونات التكافؤ من النواة فتحتاج إلى طاقة كبيرة لفصلها عن الذرة
(2) في المجموعة الرأسية:-
يقل جهد التأين من أعلى إلى أسفل أي بزيادة العدد الذري
السبب في ذلك هو زيادة نصف القطر وذلك بسبب
أ- زيادة عدد المستويات الرئيسية
ب- يزداد حجب شحنة النواة بسبب وجود المستويات الحاجبة
جـ - فيبتعد الإلكترون عن النواة فتسهل إزالته
- الأشكال التالية توضح تدرج طاقة التأين للعناصر فى الدورات والمجموعات:

حل السؤال: أى من العناصر التالية هو العنصر الأكبر في طاقة التأين : الليثيوم / البريليوم / البورون / الكربون؟
الحل:
نكتب التوزيع الألكتروني للعناصر السابقة
Li3 : 1s2 , 2s1 الليثيوم
Be4 : 1s2 , 2s2 البريليوم
B5 : 1s2 , 2s2 , 2p1 البورون
C6 : 1s2 , 2s2 , 2p2 الكربون
- نجد أن العناصر التالية متتابعة فى العدد الذري لذلك فهى تقع فى دورة واحدة ويكون ترتيبها من اليسار يسار الجدول الدوري كالتالي: الليثيوم ثم البريليوم ثم البورون ثم الكربون
- كما ذكرنا أعلاه فأن طاقة التأين تزداد فى الدورات كلما اتجهنا ناحية يمين الجدول أي بزيادة العدد الذرى لذلك فأن ترتيب هذة العناصر حسب طاقة التأين هو
C6 > B5 > Be4 > Li3
ويكون الكربون هو أعلى هذه العناصر فى طاقة التأين