مبدأ البناء التصاعدي Auf-bau principle
- كل مستوى طاقة يحتوي على عدد من مستويات الطاقة الفرعية التى تختلف عن بعضها اختلافاً طفيفاً فى الطاقة، لذا يكون الترتيب الحقيقي للطاقة فى الذرة حسب ترتيب مستويات الطاقة الفرعية.
- ينص مبدأ البناء التصاعدي على أنه:
"لابد للإلكترونات أن تملأ المستويات الفرعية ذات الطاقة المنخفضة أولاً ثم المستويات الفرعية ذات الطاقة الأعلي"
- تترتب المستويات الفرعية تصاعدياً كما هو موجود بالشكل التالي:

أهم خواص رسم أوفباو
(1) طاقة المستويات الفرعية في المستوى الثانوي جميعها متساوية
حيث تجد أن المستوىات الفرعية الثلاثة في المستوى الثانوي 2p جميعها متساوية الطاقة.
(2) في الذرة المتعددة الإلكترونات تكون طاقة المستوىات الثانوية المختلفة ضمن مستوى الطاقة الرئيس الواحد مختلفة.
حيث تجد أن طاقة المستوىات الفرعية الثلاثة في المستوى الثانوي 2p أعلى من طاقة المستوى الفرعي 2s
(3) تسلسل زيادة طاقة المستوىات الثانوية ضمن مستوى الطاقة الرئيسي الواحد هو f,d,p,s.
فإذا كان n=4 فسيكون التسلسل لمستويات الطاقة الثانوية 4f,4d,4p,4s
(4) تستطيع مستويات الطاقة الثانوية لمستوى رئيسي أن تتداخل مع مستويات الطاقة الثانوية ضمن مستوى رئيسي آخر.
حيث تكون طاقة المستوى الفرعي فى المستوى الثانوي 4s أقل من طاقة المستويات الفرعية الخمسة في المستوى الثانوي 3d.
حساب عدد الألكترونات فى مستوى طاقة معين
عدد الألكترونات (-e) التى يتشبع بها مستوى طاقة معين تساوي ضعف مربع رقم الغلاف (2n2) حيث (n) تساوي رقم الغلاف:
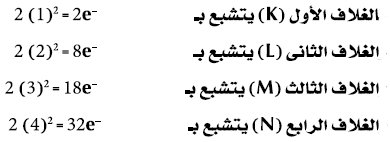
السؤال: المستويات الفرعية للمستوي الثالث تتحمل (18) الكترون لماذا في التوزيع العادي نوزع بها (8) الكترونات فقط؟
مما سبق نستنتج أن:
المستوى الثالث (M) يتشبع بعدد (18) ألكترون حيث يتكون المستوى الثالث من:
M = 3s + 3p + 3d
يتسع الأوربتال (s) لعدد(2) ألكترون ، والاوربتال (P) لعدد (6) ألكترون ، والاوربتال (d) لعدد (10) ألكترون وبالتالي يكون:
M = 2 + 6 + 10 = 18
لكن نجد أن عدد الألكترونات في المستوى الثالث فى بعض الأحيان يكون (8) فقط ويتبقى الكترونات لا توضع فى المستوى الثالث وذلك لأن المستوى الفرعي (4s) يملأ أولاً قبل المستوى الفرعي (3d) حسب مبدأ البناء التصاعدي أعلاه فيظهر التوزيع الألكتروني مثلاُ 2 , 8 , 8 , 2 ( 1s2 , 2s2 2p6 , 3s2 3p6 , 4s2) وليس على الصيغة 11 , 8 , 2 ( 1s2 , 2s2 2p6 , 3s2 3p6 3d2)