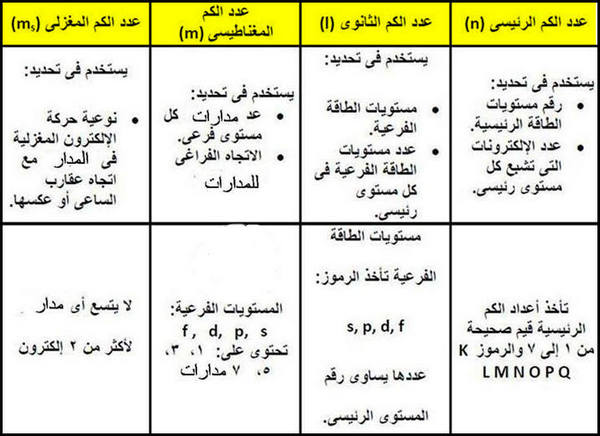
أعداد الكم Quantum numbers
- أعطى الحل الرياضي للمعادلة الموجية لشرودنجر أربعة أعداد سميت بأعداد الكم.
- يلزم لتحديد طاقة الإلكترون في الذرات عديدة الألكترونات معرفة قيم أعداد الكم التى تصفه وعددها أربعة وهي:
(1) عدد الكم الرئيسي (n) الذي يصف بعد الألكترون عن النواة.
(2) عدد الكم الثانوي (L) الذي يصف اشكال السحابة الألكترونية للمستويات الفرعية.
(3) عدد الكم المغناطيسي (mL) الذي يصف شكل ورقم الأوربتال الذي يوجد به الإلكترون.
(4) عدد الكم المغزلي (ms) الذي يصف الدوران المغزلي للإلكترون.
أولاً/ عدد الكم الرئيسي (principle Quantum Number :(n
- يستخدم عدد الكم الرئيسي (n) فى تحديد مايلي:
(1) رتبة مستويات الطاقة الرئيسية أو الأغلفة الإلكترونية وعددها في أثقل الذرات المعروفة وهلى فى الحالة المستقرة ground state تساوي (7).
(2) عدد الألكترونات (-e) التى يتشبع بها مستوى طاقة معين تساوي ضعف مربع رقم الغلاف (2n2) حيث (n) تساوي رقم الغلاف:
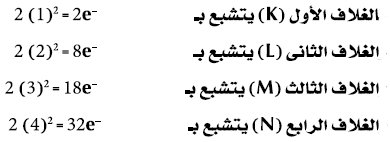
ثانياً/ عدد الكم الثانوي: (Subsidary Quantum Number (l
- يتميز عدد الكم الثانوي بما يلي:
(1) يحدد مستويات الطاقة الفرعية فى كل مستوى طاقة رئيسي.
(2) المستوى الرئيسي يحتوى على عدد من مستويات الطاقة الفرعية يساوي رقمه.
(3) تأخذ المستويات الفرعية الرموز والقيم الموضحة بالجدول التالي:
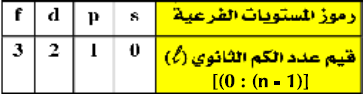
- يلاحظ اختلاف المستويات الفرعية لنفس المستوى الرئيسي عن بعضها في الطاقة اختلافاُ بسيطاُ ويمكن ترتبها حسب طاقتها كما يلي: f > d > p > s
ثالثاُ/ عدد الكم المغناطيسي (Magnetic Quantum number (ml
- يتميز عدد الكم المغناطيسي بالآتي:
(1) يمثل عدد الكم المغناطيسي عدد الأوربتالات التى يحتوى عليها مستوى فرعي معين واتجاهاتها الفراغية.
(2) يمثل بقيم عددية صحيحة فردية تتراوح مابين (l , ..... , 0 , ......., +l-)
رابعاً/ عدد الكم المغزلي (Spin quantum Number (ms
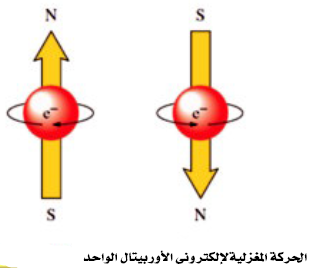
- يحدد عدد الكم المغزلي (ms) نوعية حركة الألكترون المغزلية فقد تتخذ الحركة اتجاة عقربي الساعة (↑) وتكون قيمة (ms) له (1/2+) أو عكسها (↓) وتكون قيمة (ms) له (1/2-)
- لا يتسع أى أوربتال لأكثر من إلكترونين يدور كل منهما حول محوره ، وذلك أثناء دورانه حول النواة.
ويمكن تخيل ذلك لو تصورنا دوران الارض حول نفسها أثناء دورانها حول الشمس.
- وبالرغم من أن إلكتروني الأوربتال الواحد يحملان نفس الشحنة السالبة فقد يتبادر إلى الذهن أنهما يتنافران ، الإ أن ما يحدث فعلاُ هو أنه نتيجة لدوران الألكترون حول محورة في إتجاه معين يتكون مجال مغناطيسي يعاكس اتجاة المجال المغناطيسي الناشي عن دوران الألكترون الآخر حول محوره. ويقال أن الإلكترون فى حالة إزدواج Paired ، ويرمز لذلك بالرمز (↑↓)
الجدول التالي يوضح دلالة كل من أعداد الكم الأربعة: