قانون التخفيف
- وفيه تتم إضافة المزيد من المذيب إلى محلول ذي تركيز معين.
- وبالتالي فإن تركيز المحلول يقل بسبب زيادة الحجم،إلا أن كمية المذاب تظل كما هي قبل وبعد التخفيف.
- وبالتالي فعدد المولات قبل التخفيف يساوي عدد المولات بعد التخفيف.
- ونعلم أن عدد المولات يحسب من حاصل ضرب التركيز بالمولارية (M) في حجم المحلول باللتر أو بالمللتر.
القانون :
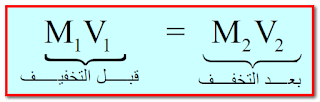
حيث:
M1 : تركيز المحلول الإبتدائي (قبل التخفيف)
M2 : تركيز المحلول النهائي (بعد التخفيف - يعد إضافة مزيد من المذيب)
V1 : حجم المحلول الإبتدائي (قبل التخفيف - قبل إضافة المذيب)
V2 : حجم المحلول النهائي (بعد التخفيف - بعد إضافة المذيب)
وبالتعويض فى القانون نجد أن :
M1 * V1 = M2 * V2
0.80 * 1 = 0.25 * V2
V2 = 3.2 L