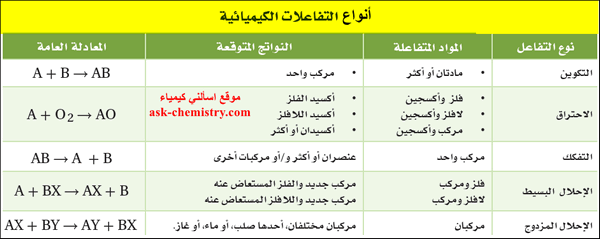
أنواع التفاعلات الكيميائية Types of chemical reactions
- الجدول التالي يوضح أنواع التفاعلات الكيميائية - المواد المتفاعلة لكل نوع - المواد الناتجة - المعادلة العامة لكل نوع
تفاعلات الإحلال Replacement Reactions
هناك الكثير من التفاعلات التى تتضمن إحلال عنصر محل عنصر آخر في مركب، وتسمى هذة التفاعلات تفاعلات الإحلال.
- هناك نوعان من تفاعلات الإحلال وهما:
(1) الأحلال البسيط
(2) الإحلال المزدوج
أولاً/ تفاعلات الإحلال البسيط
- تفاعلات الإحلال البسيط وهو التفاعل التى تحل فية ذرات عنصر محل ذرات عنصر آخر في مركب
- المعادلة العامة لتفاعلات الإحلال البسيط هي:
A + BX → AX + B
(1) إحلال فلز محل الهيدروجين
- هو أحد أنواع تفاعلات الإحلال البسيط حيث تحل ذرة فلز محل ذرة هيدروجين فى مركب.
- التفاعل بين الليثوم والماء أحد الأمثلة على على هذا النوع.
- حيث تحل ذرة فلز (الليثوم) محل ذرة واحدة من ذرتي هيدروجين في جزئ الماء
(2Li(s) + 2H2O(l) → 2LiOH(aq) + H2(g
(2) إحلال فلز محل فلز آخر
- - يحدث نوع آخر من الإحلال البسيط عندما يحل فلز محل فلز آخر في مركب مذاب فى الماء.
- يبين المعادلة التالية حدوث تفاعل احلال بسيط عند وضع صفيحة من النحاس في محلول مائي من نترات الفضة. فالبلورات المتراكمة على قطعة النحاس هي ذرات الفضة التى حلت محلها ذرات النحاس.
(Cu(s) + 2AgNO3(aq) → Cu(NO3)2(aq) + 2Ag(s
(3) احلال لافلز محل لافلز آخر
هناك نوع ثالث من تفاعلات الإحلال البسيط، حيث يحل فيه لافلز محل لافلز آخر في مركب. كما هو شائع في بعض تفاعلات الهالوجينات.
- الهالوجينات لافلزات وهي كالفلزات فهي تظهر مستويات مختلفة من النشاط في تفاعلات الإحلال
- يبين الشكل التالي سلسلة النشاط للهالوجينات

- تبين السلسلة أن الفلور أنشط الهالوجينات واليود أقلها نشاطاً.
- الهالوجين الأنشط يحل محل الهالوجين الأقل نشاطاً في مركب ذائب فى الماء
فالفلور مثلاً يحل محل البروم في محلول مائي لبروميد الصوديوم . لكن لايحل البروم محل الفلور في محلول مائي لفلوريد الصوديوم.
(F2(g) + 2NaBr(aq) → 2NaF(aq) + Br2(l
Br2(l) + 2NaF(aq) → No reaction
ثانياً/ تفاعلات الإحلال المزدوج
- يسمى التفاعل الذي يتم فيه تبادل الأيونات بين مركبين تفاعل الإحلال المزدوج.
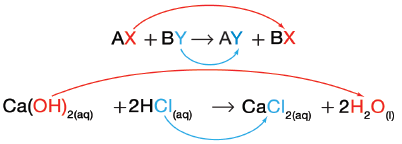
- يمثل الرمزان B , A في هذة المعادلة أيونين موجبين بينما يمثل الرمزان X , Y أيونين سالبين. لاحظ أن الأيونين السالبين قد تبادلا موقعيهما، وصارَا مرتبطين بأيونين موجبين مختلفين.
- بمعنى آخر حل X محل Y ، وحل Y محل X ولهذا السبب يسمى التفاعل تفاعل الإحلال المزدوج.
أمثلة توضيحية
(1) تفاعل هيدروكسيد الكالسيوم وحمض الهيروكلوريك
(Ca(OH)2(aq) + 2HCl(aq) → CaCl2(aq) + 2H2O(l
الأيونات في التفاعل هي: -Ca2+ , -OH , H+ , Cl
لاخظ أن الأيونين السالبين: Cl- ، -OH قد غيرا موقعهما ، وارتبطا بالأيونين الموجبين +Ca2+ , H على الترتيب.
(2) تفاعل هيدروكسيد الصوديوم مع كلوريد النحاس II
(2NaOH(aq) + CuCl2(aq) → 2NaCl(aq) + Cu(OH)2(s
لاحظ أن الأيونين السالبين: Cl- ، -OH قد غيرا موقعهما ، وارتبطا بالأيونين الموجبين +Na+ , Cu2 على الترتيب.
- ناتج هذا التفاعل مادة صلبة لا تذوب في الماء وهي هيدروكسيد النحاس II وتسمى المادة الصلبة التى تنتج خلال تفاعل كيميائي في محلول ما راسباً.
نواتج تفاعلات الإحلال المزدوج
- إحدى المميزات الأساسية لتفاعلات الإحلال المزدوج هى نوع الناتج المتكون عندما يحدث التفاعل، فجميع هذة التفاعلات تنتج ماءً أو راسباً أو غازاَ.
(1) أحدى النواتج ماء
(Ca(OH)2(aq) + 2HCl(aq) → CaCl2(aq) + 2H2O(l
(2) أحدى النواتج راسب
(2NaOH(aq) + CuCl2(aq) → 2NaCl(aq) + Cu(OH)2(s
(3) أحدي النواتج غاز
(KCN(aq) + HBr(aq) → KBr(aq) + HCN(g