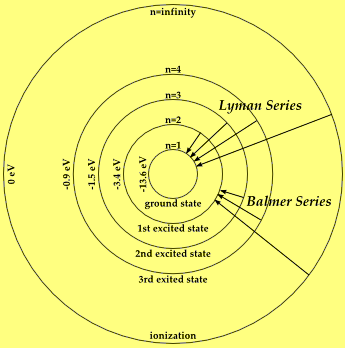
أوضحت حسابات بور لأنصاف أقطار مستويات الطاقة ومقدار طاقة كل مستوى أن الفرق في الطاقة بينها ليس متساوياً فهو يقل كلما بعدنا عن النواة وعلى ذلك فالكم من الطاقة اللازم لنقل الإلكترون بين مستويات الطاقة المختلفة ليس متساوياً.
- المعنى من الجملة السابقة هى أن أذا كان الفرق بين مستوى الطاقة الأول (K) ومستوى الطاقة الثاني (L) هو 10.3ev فأن الفرق بين المستوى الطاقة الثاني (L) ومستوى الطاقة الثالث (M) لابد أن يكون أقل من 10.3ev وذلك لأن الفرق في الطاقة بين مستويات الطاقة يقل كلما بعدنا عن النواة.
حساب الفرق فى الطاقة بين مستويات الطاقة الرئيسية
- يتم حساب طاقة أى مستوى طاقة رئيسي من القانون التالي:
E = -E0 / n2
حيث: E0 = 13.6ev ، ورقم مستوى الطاقة الرئيسي ..... ,n = 1,2,3
- يتم التعبير عن الطاقة كرقم سالب لأن الأمر يتطلب الكثير من الطاقة لفك (تأين) الإلكترون من النواة.
- من الشائع أن نقول إن الإلكترون غير المرتبط به طاقة صفرية. نظرًا لأن الإلكترون المرتبط بذرة يمكن أن يكون له طاقات معينة فقط ، فإن الإلكترون يمكنه فقط امتصاص فوتونات ذات طاقات معينة تتوافق تمامًا مع فرق الطاقة ، أو "قفزة كمية" ، بين حالتين للطاقة.
- حساب طاقة المستوى الرئيسي الأول (K) يكون كالتالي:
EK = -E0 / n2
EK = -13.6 / (1)2
EK = -13.6
- حساب طاقة المستوى الرئيسي الثاني (L) يكون كالتالي:
EL = -E0 / n2
EL = -13.6 / (2)2
EL = -3.4
- حساب طاقة المستوى الرئيسي الثالث (M) يكون كالتالي:
EL = -E0 / n2
EL = -13.6 / (3)2
EL = -1.5
حساب الفرق بين مستويات الطاقة الرئيسية
- الفرق فى الطاقة بين مستوى الطاقة الأول (K) ومستوى الطاقة الثاني (L) =
(E2 - E1 = -3.4 - (-13.6
= 10.2eV
- الفرق فى الطاقة بين مستوى الطاقة الثاني (L) ومستوى الطاقة الثالث (M) =
(E3 - E2 = -1.5 - (-3.4
= 1.9eV
ويمكن حساب الفرق فى الطاقة مباشرة بين مستويين طاقة عن طريق العلاقة التالية:
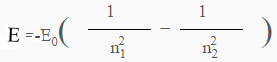
ولإيجاد الفرق مباشرة بين مستوى الطاقة الثاني (L) ومستوى الطاقة (M) وبوضع: n1 = 2 , n2 = 3 , E0 = 13.6ev فى المعادلة السابقة فأن: E= -1.9