الفوسفور Phosphorus
– هوعنصر من عناصر الجدول الدوري ، العدد الذري= 15 العدد الكتلي = 31
– التوزيع الإلكتروني له : 1S2 , 2S2 2P6 , 3S2 3P3
– هو عبارة عن عنصر لا فلز ، له عدة أشكال متأصلة أهمها الفوسفور الأبيض والفوسفور الأحمر.
– الفسفور الأبيض هو الصورة المعتادة للفوسفور، يوجد على هيئة مادة جامدة صفراء باهتة اللون، وهي لينة إلى حد ما عند تدفئتها، ولكنها تصبح هشة عند تبريدها.
– والفسفور الأبيض شديد السمية وتكفي جرعة صغيرة منه لإحداث الوفاة.
– الفسفور الأحمر فلا رائحة له، وهو غير سام، لذلك يعد الصورة المعتادة للفوسفور المستخدم في التفاعلات الكيميائية.
ظهور المستوى 3d فى الفوسفور
- ينتهى التوزيع الألكتروني للفوسفور بالمستوى الفرعي 3p فكيف يظهر المستوى الفرعي 3d فى هذا العنصر؟
- يمكن أن نجيب على هذا السؤال ولكن بسؤال آخر وهو كيف لذرات الفوسفور أن تكون خماسية التكافؤ والمستوى الفرعي الأخير 3p يحتوى على ثلاث إلكترونات مفردة فقط.

الإجابة:
هو أن الفوسفور عند الترابط أو التهجين ينتقل إلكترون من زوج الإلكترونات فى المستوى الفرعي (3s) إلى المستوى الفرعي (3d) الفارغ وتتكون 5 ألكترونات مفردة فى المستويات 3s , 3p , 3d أو 5 أوربتالات مهجنة (أوربتال واحد فى 3s وثلاث أوربتالات فى 3p واوربتال واحد فى 3d) لذلك يكون التهجين من النوع sp3d كما فى جزئ PCl5
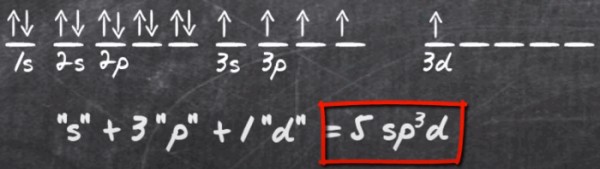

- أما فى حالة PCl6 يكون التهجين من النوع sp3d2 أى أن المستوى الفرعي 3d يحتوى على إلكترونين ويتأخذ شكل ثماني الوجوه.
- الخلاصة: هى أن الفوسفور وليس النيتروجين يستخدم أوربتالات المستوى الفرعي 3d فى الترابط