معادلة نرنست Nernst Equation
- یتم رسم منحنیات الأكسدة والاختزال بالاستعانة بمعادلة نرنست ویعبر منحنى المعایرة عن التغیر في تركیز المادة المراد تعینها ، وذلك بدلالة المادة القیاسیة
- توضح معادلة نرنست العلاقة بین الجهد والتركیز بذلك یمكن تمثیل منحنى معایرة الأكسدة والاختزال برسم العلاقة بین مللترات المادة القیاسیة (یمكن أن یكون عاملاً مختزلاً أو مؤكسدا ) وقیم الجهد التي تقابل كل إضافة.
- ویتم حساب الجهد باستخدام معادلة نرنست التي توضحها العلاقة التالیة:
فى هذا التفاعل:
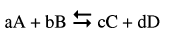
يكون جهد القطب E
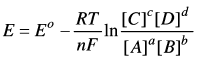
R = الثابت العام للغازات
T = درجة الحرارة المطلقة
F = ثابت فارادي
n = عدد الألكترونات المتنقلة
a , b , c , d = معاملات الجزيئات فى المعادلة الموزونة
ويمكن كتابة المعادلة بعد تجميع ثابت فارادى وثابت الغازات ودرجة الحرارة وتحويل ln إلى اللوغارتيم العشري log :
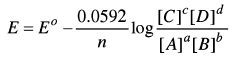
تمرين محلول
أحسب الجهد القطبي لكل من النحاس والخارصين فى خلية تتألف من ما في تراكيز :
(أ) Zn2+] = 0.01 M, [Cu2+] = 0.001M]
(ب) Zn2+] = 0.001 M, [Cu2+] = 0.01M]
عند درجة حرارة 25Co علماً بأن جهود الإختزال القياسية هي:
ECu = 0.337 V , Eozn = - 0.7630 V
الحل:
