طاقة التأين Ionization Energy
- طاقة التأين هي أدني طاقة تكفي لانتزاع إلكترون من الذرة في وضعها المستقر وحالتها الغازية.
- أو هى مقدار الطاقة بالكيلوجول اللازمة لنزع مول واحد من الألكترونات من مول واحد من الذرات الغازية.
- وحدة قياس طاقة التأين kJ/mol
- وقد خصصت الذرات الغازية فى هذا التعريف لأنه من المفترض أن الذرة في الطور الغازي لا تتأثر بمجاوراتها ولذلك فلا وجود للقوى بين الجزيئية (أى قوى ما بين الجزيئات intermolecular forces) لتؤخذ فى الحسبان عند قياس طاقة التأين.
- إن مقدار طاقة التأين هو مقياس لشدة تمسك الذرة بالإلكترون فكلما ازدادت طاقة التأين أصبحت إزالة الإلكترون أكثر صعوبة.
- طاقة التأين الأولى (I1) هو مقدار الطاقة اللازمة لإزالة الإلكترون الأول في حالة الذرة كثيرة الإلكترونات
- توضح المعادلات التالية طاقة التأين الأولى والثانية والثالثة للعنصر (X)

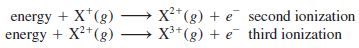
وتتواصل إزالة الإلكترونات الآتية على هذا النحو.
السؤال: لماذا يكون الفرق بين قيمتي جهد التأين الأول والثاني يكون كبيراً جداً بالنسبة لذرات عنصرالصوديوم؟
- العدد الذري لعنصر الصوديوم:
Na11 : 1s2 , 2s2 2p6 , 3s1
- جهد التأين الأول تسبب فى أزالة الإلكترون الموجود فى 3s وهذا سهل جداً
-Na + energy → Na+ + e
- جهد التأين الثاني يتسبب فى إزالة إلكترون من مستوى طاقة مكتمل بالإلكترونات وهو 2p وهذا صعب جداً.
-Na+ + energy → Na2+ + e
- لذلك ستكون طاقة التأين الثانية أكبر بكثير من طاقة التأين الأول لأنها تسبب فى كسر مستوى طاقة مكتمل بالإلكترونات.
- نلاحظ أن جهد التأين الأول للصوديوم = 495 كيلوجول/مول وجهد التأين الثاني للصوديوم = 4650 كيلوجول/مول